20230303康测科技助力郑大附一内分泌科秦贵军团队发表Cell Proliferation

#
引言
本期带来的是康测科技RIP-seq的客户文献,该文献主要通过寻找糖尿病肾病(DKD)肾小管细胞中特异表达的lncRNA出发,探讨lncRNA在DKD疾病中的作用和调控机制。其中RIP-seq主要贡献是提供RBMX与PWARSN lncRNA结合的证据和区域,为RIP-qPCR引物设计提供指导。
#
研究背景
糖尿病肾病(DKD)是世界范围内导致终末期肾脏疾病的主要原因。先前的研究集中于肾小球的病理损伤;然而,多项研究可以证实肾小管损伤在DKD的进展中起的关键作用。糖尿病环境中的代谢紊乱、血流动力学变化和氧化应激可导致肾小管炎症、近端肾小管上皮细胞(PTEC)死亡和间质纤维化,最终发展为DKD。然而,在DKD中启动和介导肾小管上皮细胞损伤的病理机制仍不清楚。
硫氧还蛋白相互作用蛋白(TXNIP)属于硫氧还蛋白家族,与硫氧还蛋白结合,可以抵抗静息细胞中的氧化应激。许多研究报道,高血糖促进TXNIP与硫氧还蛋白的分离,导致过度的氧化应激和活性氧(ROS)的产生。之前的研究报道显示TXNIP在DKD的进展中具有关键作用。TXNIP诱导的ROS积累在DKD中以NLRP3炎症依赖的方式启动细胞焦亡。越来越多的证据表明lncRNA参与DKD的调节,但是lncRNA对DKD肾小管损伤的影响处于未知状态。为了深入了解DKD发展的分子机制,寻找新的分子标记比如lncRNA,提高DKD诊断和治疗的水平,作者开展了如下研究。
#
研究结果
1.DKD患者TXNIP和NLRP3表达水平异常并引起肾小管上皮细胞焦亡
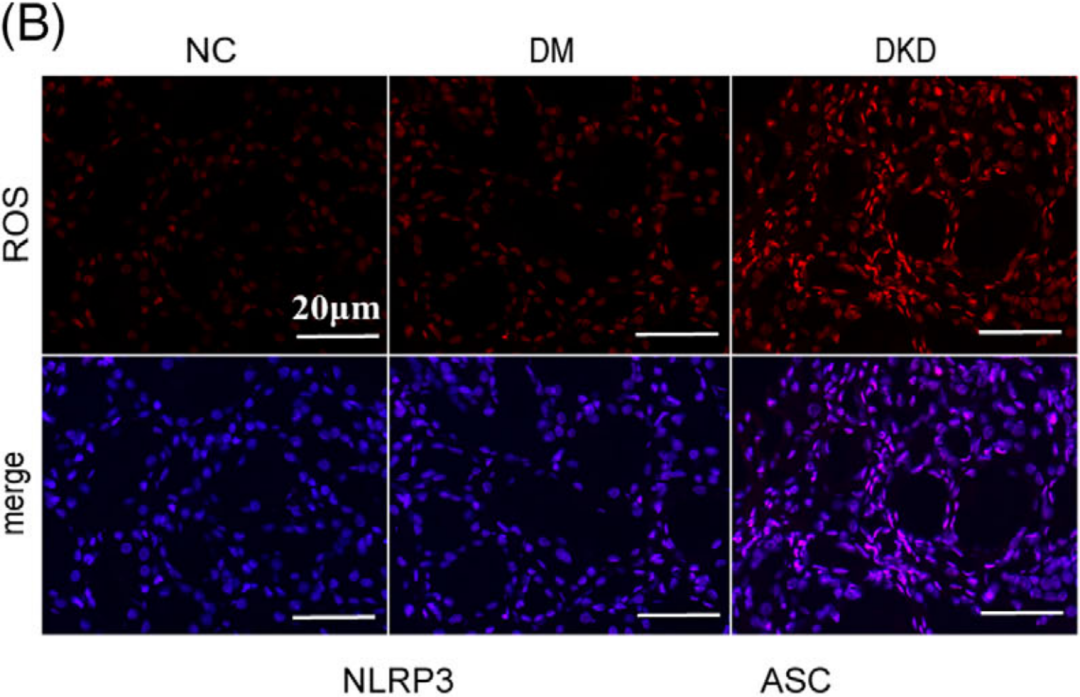
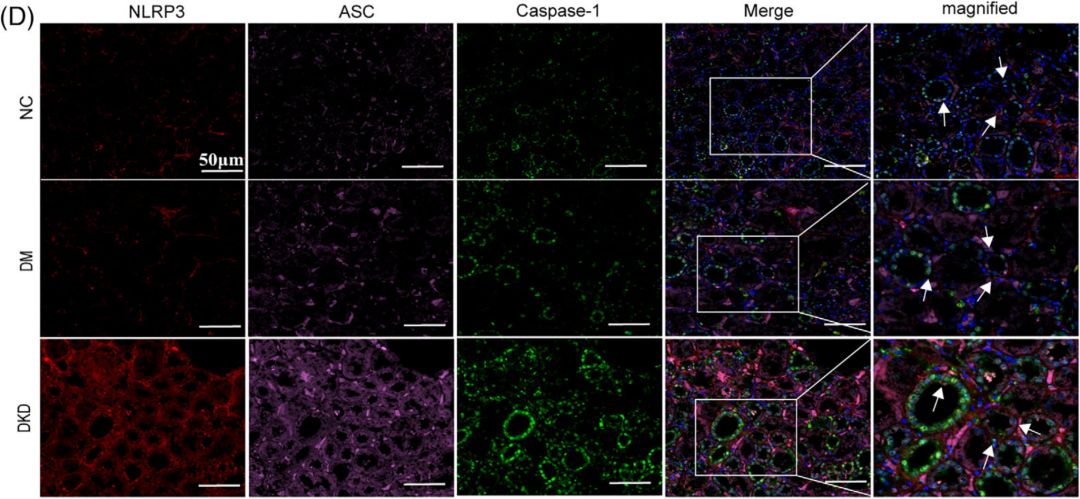
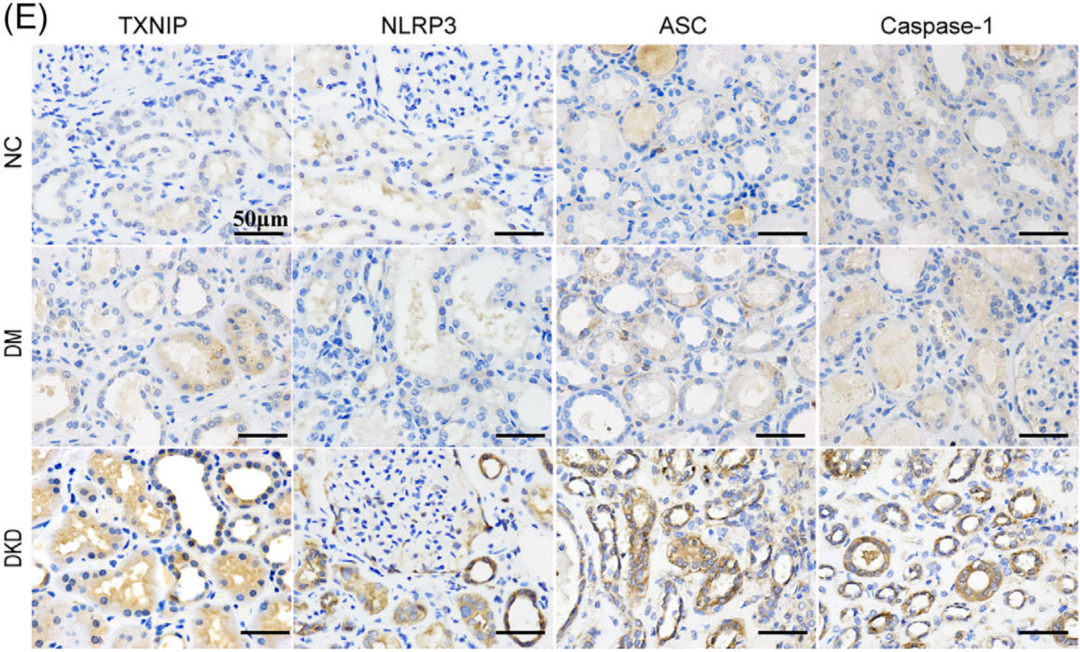
作者首先收集糖耐量正常(NGT)的患者、Ⅱ型糖尿病(DM)但未患DKD的患者以及DKD患者的组织样本,免疫荧光分析显示DKD患者肾组织线粒体活性氧(MitoROS)和ROS水平显著升高,并伴有NLRP3炎症体(NLRP3、ASC和Caspase-1)共存增加(图B、D);同时检测TXNIP和NLRP3炎症体的表达水平,通过免疫组化证实TXNIP、NLRP3、ASC和Caspase-1的表达水平显著升高(图E)。
接下来,作者对于TXNIP在正常糖(NG)和高糖(HG)条件下培养的PTEC(HK-2细胞)激活NLRP3炎症体和细胞焦亡的作用进行了评估。通过IncuCyte法检测细胞动态死亡和超微结构改变,以及扫描电子显微镜结果,证实了TXNIP诱导的NLRP3炎性小体激活和随后的细胞焦亡参与了DKD的发展。
2. PTEC特异的lncRNA PWARSN在病理上与DKD相关
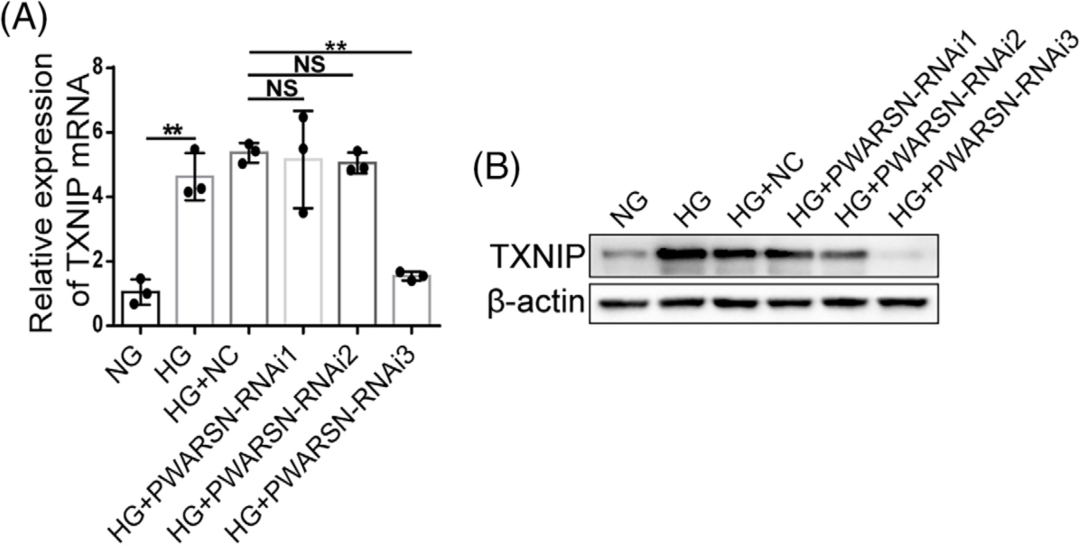
为了探索TXNIP/NLRP3信号在DKD肾小管中激活的分子机制,作者对NG和HG处理72 h的HK-2细胞进行了全转录组RNA芯片分析,(康测科技lncRNA-Seq亦可实现此需求),结果显示HG组细胞中TXNIP mRNA表达水平显著上调,在构建的lncRNA-TXNIP共表达网络中鉴定出11个与TXNIP相关的lncRNA,qRT-PCR验证后鉴定出5个特异表达的lncRNA,lncRNA PWARSN(也称为NR_0221011)表达水平在HG组明显升高,PWARSN在物种间的保守性很差并且无编码能力,随后敲低PWARSN后对TXNIP的mRNA和蛋白水平有影响(图A/B),因此作者选择PWARSN进行进一步研究。
作者对肾脏进行了荧光原位杂交(FISH)分析,发现PWARSN主要位于DKD患者的肾小管(图C)。
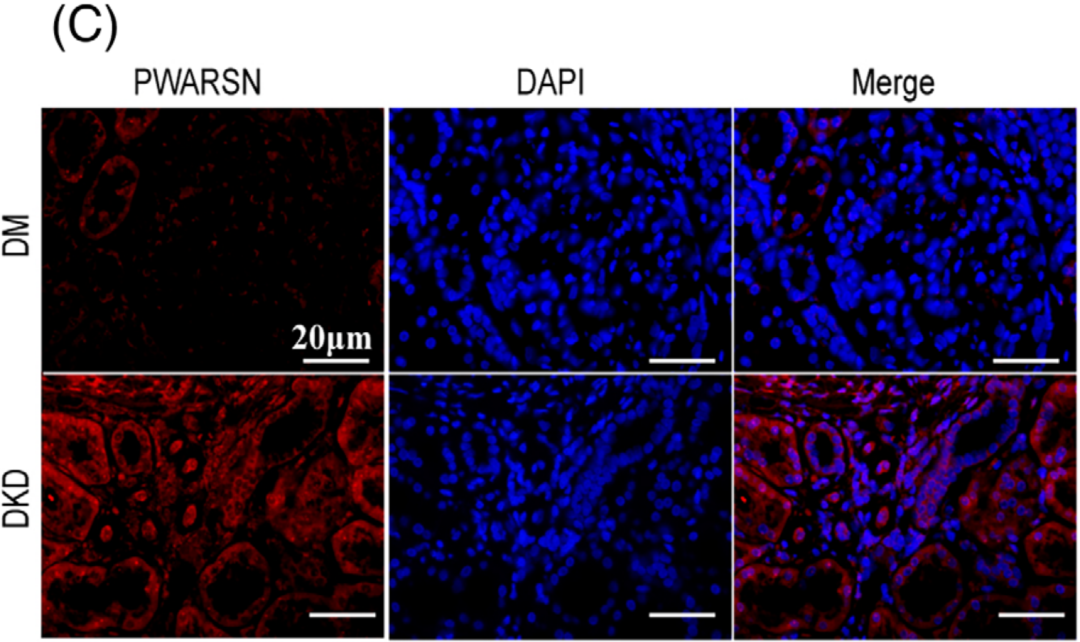
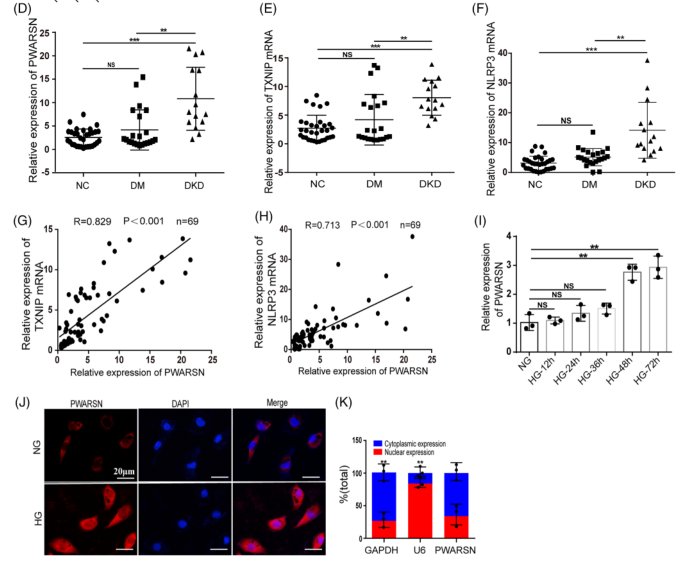
然后检测了32例NGT患者、22例DM但无DKD患者和15例DKD患者的肾小管PWARSN、TXNIP和NLRP3的表达,qRT-PCR结果显示,DKD患者PWARSN、TXNIP和NLRP3基因表达水平显著高于NGT和DM患者,但在NGT和DM患者中表达量没有显著变化(图D-F)。而且发现PWARSN和TXNIP及NLRP3 mRNA水平之间存在很强的相关性(图G/H)。这表明PWARSN与DKD肾小管中的TXNIP/NLRP3密切相关。亚细胞定位显示PWARSN分布于PTEC的细胞质和细胞核中(图J/K)。
3. PWARSN可以触发TXNIP/NLRP3诱导的肾小管上皮细胞焦亡
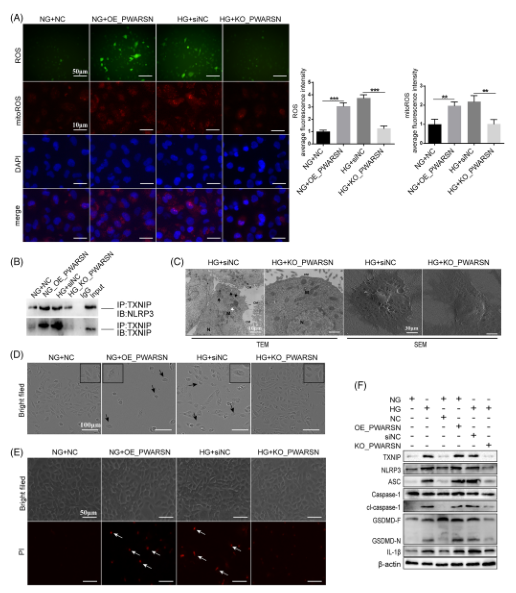
为了进一步探索PWARSN在PTEC中的生物学功能,作者使用慢病毒系统过表达PWARSN,并使用CRISPR-Cas9系统在HK-2细胞中敲除PWARSN,结果显示过表达PWARSN可以促进ROS和mitoROS 的生成(图A);CO-IP结果表明TXNIP-NLRP3相互作用在PWARSN过表达细胞中得到增强,但在敲除PWARSN细胞中受到抑制(图B)。扫描电子显微镜和TEM(图C)、IncuCyte 测定(图D)和HK-2细胞中的PI染色(图E)结果表明PWARSN可以促进PTEC细胞焦亡,并进行了WB验证(图F)。
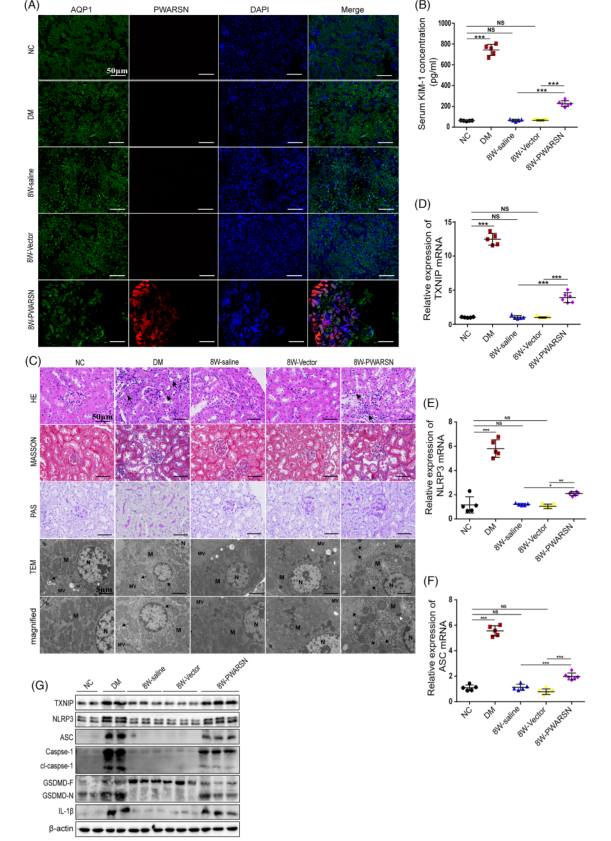
下一步将人PWARSN质粒转染到小鼠肾小管上皮细胞 (mRTEC) 中,检测各项生化指标发现AAV9-PWARSN注射8周后小鼠肾损伤生化指标升高,但体重或血糖水平无明显影响;肾小管细胞萎缩增加、肾小管基底膜增厚和焦亡mRTEC超微结构显著改变(线粒体肿胀和嵴丢失)(图A-C);免疫荧光染色结果显示PWARSN促进mitoROS和ROS积累;PWARSN在mRNA和蛋白质水平上引起 TXNIP 和细胞焦亡相关蛋白表达的累加上调(图D-G)。总体这些结果表明PWARSN是一种非保守的人类lncRNA,在调控TXNIP/NLRP3诱导的DKD肾小管细胞焦亡中发挥保守功能。
4. PWARSN的靶标miRNA
为了进一步研究PWARSN调节DKD中TXNIP/NLRP3诱导的细胞焦亡的详细机制,作者寻找其靶标miRNA。首先通过ceRNA网络分析确定一些PWARSN和TXNIP相关的miRNA靶标(图A)。这些miRNA在HG组中下调表达,然而miR-372-3p在敲低PWARSN细胞中上调,在过表达PWARSN细胞中下调(图B、C)。FISH结果显示在敲低PWARSN后miR-372-3p表达水平增加(图D),通过RIP-qPCR(康测科技可以提供)、RNA相互作用组学和双荧光酶报告分析证实了miR-372-3p与PWARSN的结合(图G-I)。
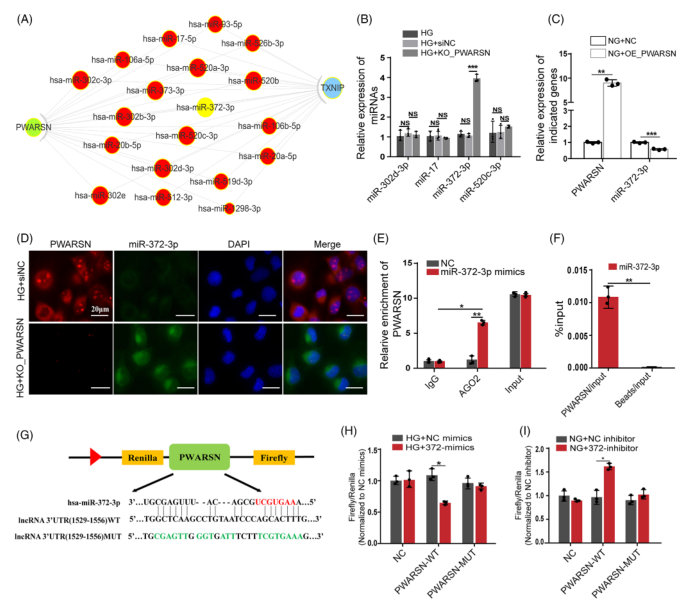
WB结果显示miR-372-3p调控HK-2细胞中的TXNIP和细胞焦亡相关蛋白的表达。使用miR-372-3p抑制剂可以消除敲除PWARSN诱导的TXNIP表达水平的下调;使用miR-372-3p mimics可以消除过表达PWARSN诱导的TXNIP水平上调(图J,K)。随后过表达PWARSN可以增加TXNIP和NLRP3的蛋白水平,但含有与miR-372-3p结合的PWARSN的3’UTR突变序列的质粒不影响TXNIP和NLRP3的蛋白水平(图L)。总的来说,这些发现表明 PWARSN的调控功能部分依赖于miR372-3p。

5. 核内PWARSN通过泛素化-蛋白酶体途径促进RBMX降解
考虑到PWARSN定位在细胞质和细胞核中,而lncRNA的作用取决于它们在细胞中的亚细胞定位。作者着重关注核内PWARSN的功能,通过ChIRP- MS未能检测到PWARSN和TXNIP蛋白之间的直接相互作用,但发现了可以调控lncRNA和TXNIP表达水平的RBMX蛋白。后续作者通过RNA Pull-down后WB、RIP-qPCR、FISH技术进一步证实了RBMX和PWARSN之间的相互作用和共定位(图A-C)。
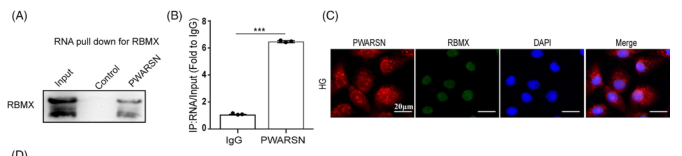
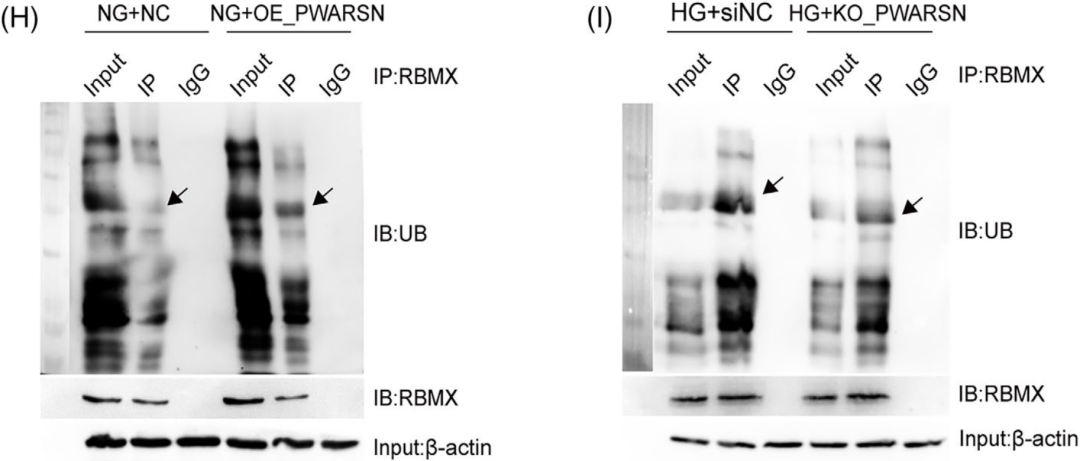
作者发现PWARSN敲除后,HK-2细胞中RBMX蛋白水平增加,但是mRNA水平没有增加(图D/E),那么PWARSN是如何从蛋白水平调控RBMX的呢?随后使用放线菌酮(蛋白合成抑制剂)处理HG细胞,发现RBMX蛋白水平降低,但是敲除PWARSN细胞没有受到影响(图F);进一步使用蛋白酶体抑制剂MG-132处理后,NG细胞和过表达PWARSN细胞中RBMX蛋白水平升高(图G);过表达PWARSN或者敲除可以影响HK-2细胞中的RBMX泛素化降解(图H/I),这些结果也说明PWARSN对RBMX蛋白水平调控是通过泛素化-蛋白酶体途径进行的。

6. PWARSN通过与RBMX相互作用调控TXNIP表达水平
PWARSN调控TXNIP表达依赖于RBMX泛素依赖性降解,而且RBMX具有转录因子功能,那么PWARSN具体是如何协作调控TXNIP表达呢?作者在康测科技进行RIP-seq,根据RIP-seq结果设计引物,通过RIP-qPCR证实RBMX在TXNIP mRNA上具有多个结合位置(图A)。随后进行荧光素酶报告基因分析,发现过表达RBMX和敲除PWARSN均可以降低由RBMX驱动的TXNIP启动子的荧光素酶活性(图B/C),然后作者克隆TXNIP启动子序列(TSS -2000到+200)构建荧光素酶载体,结果表明距离启动子-700到-300处的转录活性显著降低(图D)。
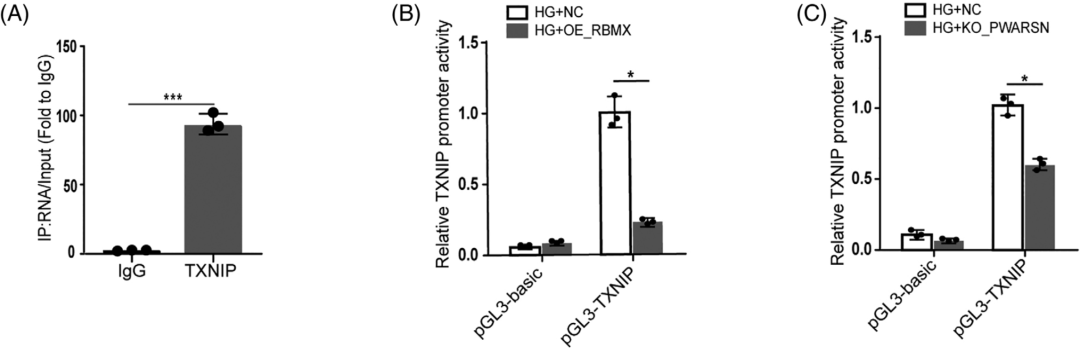
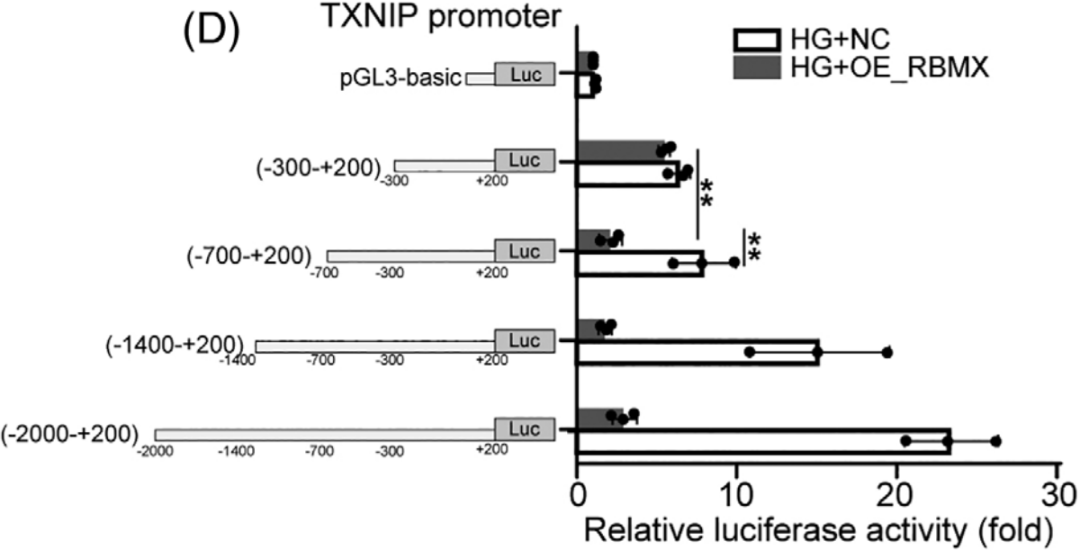
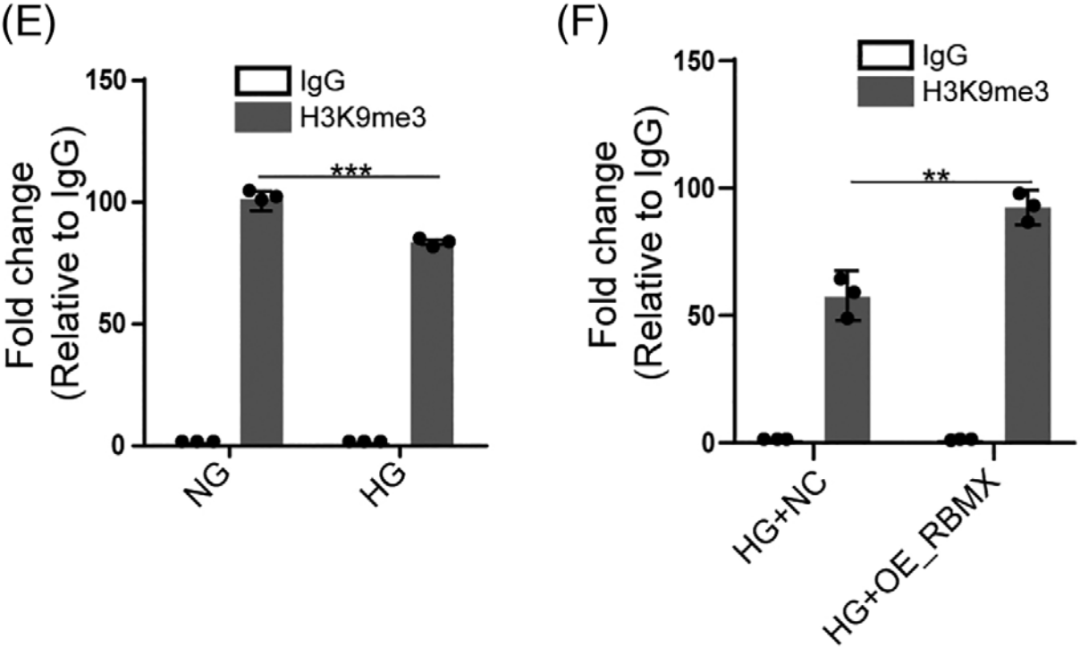
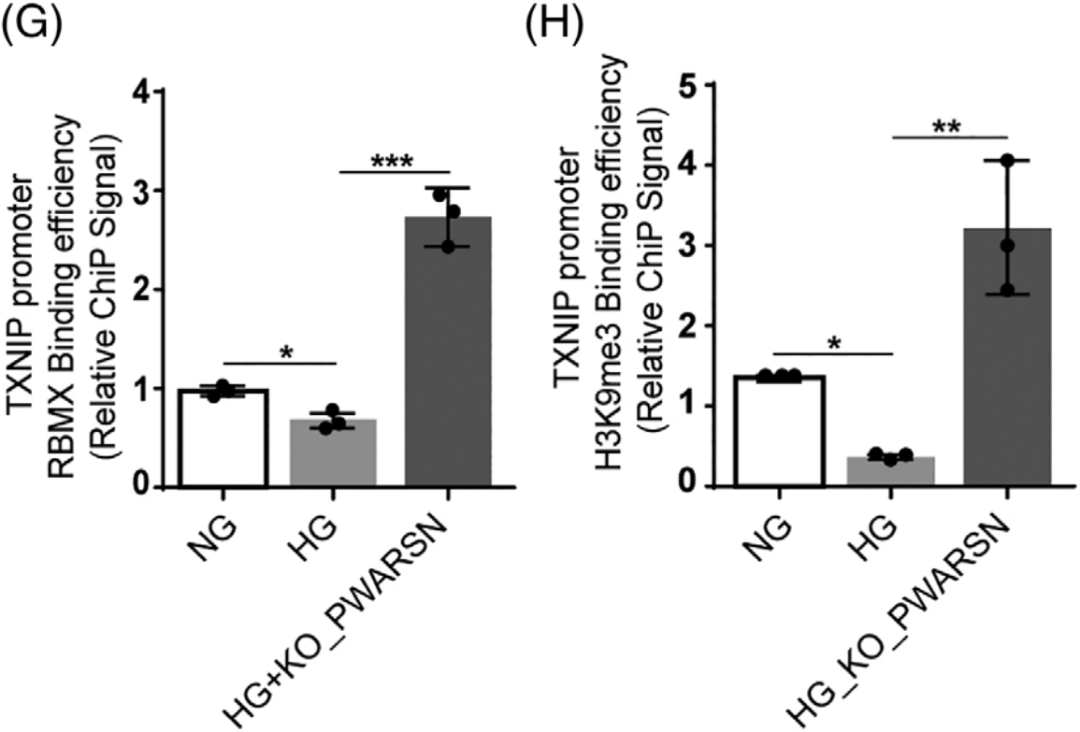
先前有研究表明RBMX招募增加H3K9me3修饰水平来调控基因沉默,通过H3K9me3 ChIP-qPCR(康测科技也可提供),发现HG组TXNIP启动子区H3K9me3的富集程度降低,但是过表达RBMX或敲除PWARSN后,富集程度增加(图E-H);
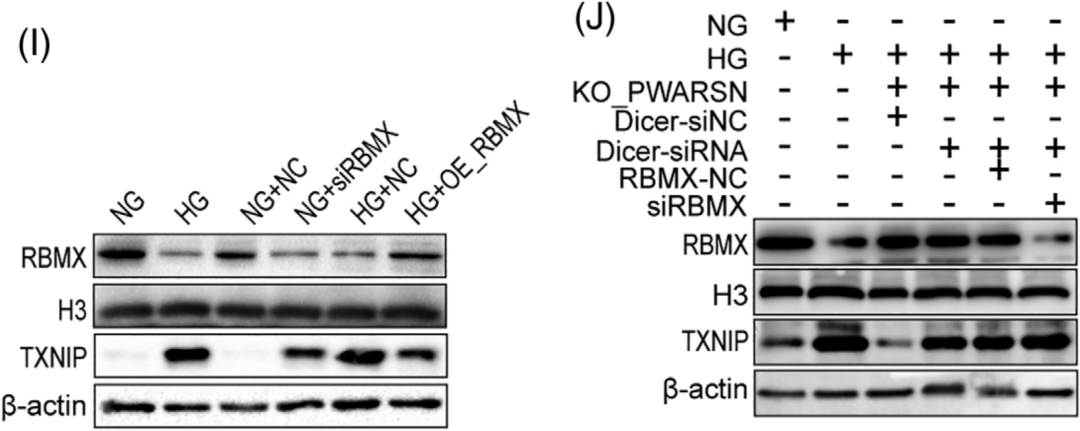
过表达RBMX可以下调HG处理细胞中TXNIP的表达水平,而敲低RBMX产生相反的效果;另外通过沉默DICER阻断miRNA产生后,敲除PWARSN无法影响沉默RBMX细胞中的TXNIP表达水平。综上所述,作者推断PWARSN可能作为诱饵并从TXNIP启动子中去除RBMX蛋白以及其它结合物,导致H3K9me3修饰减少并激活TXNIP转录(图I-J)。
最后作者探讨了PWARSN用作DKD的生物标志物的可行性,这里不再展开。
#
总结
1. 免疫组化结果显示DKD患者样本中TXNIP、NLRP3表达明显上调,通过IncuCyte法和扫描电镜确定;
2. 通过全转录组芯片分析发现PTEC特异的lncRNA PWARSN,通过FISH、qRT-PCR证明DKD患者PWARSN位于细胞质和细胞核,表达水平与TXNIP和NLRP3一样,均高于非DKD患者;
3. 过表达/敲低验证PWARSN可以促进/抑制细胞焦亡;
4. ceRNA分析找到候选靶标,RIP-qPCR、双荧光素酶酶报告系统、互作组确定PWARSN靶标miR-372-3p;使用miRNA抑制剂和mimics可以消除敲除PWARSN诱导的TXNIP表达水平的下调;使用miR-372-3p mimics可以消除过表达PWARSN诱导的TXNIP水平上调;
5. ChIRP-MS发现调控TXNIP和PWARSN的RBMX蛋白,利用RNA pull-down后WB、RIP-qPCR和FISH验证RBMX与PWARSN的结合;
6. 敲除PWARSN后,RBMX mRNA水平不变,蛋白水平下降,使用放线菌酮和蛋白酶体抑制剂发现PWARSN对RBMX蛋白水平调控是通过泛素化-蛋白酶体途径进行的;
7. RBMX本身具有转录因子功能且影响H3K9me3水平,康测科技RIP-seq和RIP-qPCR帮助作者验证RBMX在PWARSN上有多个结合位点,通过双荧光素酶报告系统发现过表达RBMX和敲除PWARSN均可以降低由RBMX驱动的TXNIP启动子的荧光素酶活性;
8. H3K9me3 ChIP-qPCR发现HG组TXNIP启动子区H3K9me3的富集程度降低,但是过表达RBMX或敲除PWARSN后,富集程度增加,说明PWARSN可能作为诱饵并从TXNIP启动子区中去除RBMX蛋白以及其它结合物,导致启动子区H3K9me3修饰减少并激活TXNIP转录。
#
参考文献
Song Y, Guo F, Zhao YY, et al. Novel lncRNA-prader willi/angelman region RNA, SNRPN neighbour (PWARSN) aggravates tubular epithelial cell pyroptosis by regulating TXNIP via dual way in diabetic kidney disease. Cell Prolif. 2023;56(2):e13349.
#
延伸阅读











