-
-
-
核心技术 >
检测服务 >
产品/解决方案>
-
染色质结构和状态与基因表达和DNA复制以及表观遗传调控密切相关,尽管转录因子、染色质相关蛋白、组蛋白修饰和DNA甲基化等已经被广泛研究,但是DNA二级结构也具有调控功能。在所有DNA二级结构中,G-四链体(G-quadruplex, G4)是是研究最多的非规范核酸构象,G4是一种四链二级结构,由多个G-四分体(G-tetrad)堆叠形成(如下图)。

随着首个光纤衍射阐明G4核心motif序列之后,越来越多研究发现G4主要定位在G-rich序列区域,并且先后在在免疫球蛋白转换区域(Immunoglobulin switch region)、端粒(Telomeres)、某些原癌基因的启动子区以及mRNA的5’UTR区域中发现。
1.在没有任何特化的解旋酶存在的情况下,G4会导致DNA聚合酶的停滞,可能导致DNA单链或双链断裂,从而导致遗传不稳定;

2.染色体末端3’端-突出部分的G4结构可以干扰端粒酶的端粒延伸并影响端粒长度;

3.启动子区G4结构干扰转录因子(TF)的结合和RNA聚合酶(RNApol)活性,从而在转录水平改变基因表达;
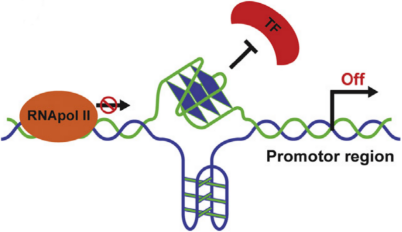
4.mRNA也可以形成G4结构,可以抑制核糖体扫描、改变剪接过程以及影响mRNA成熟和定位。
由于G4基因组定位和几个G4驱动基因的出现,G4作为潜在的癌症治疗靶点引起了很多关注。在过去的二十年中,大量证据表明G4结构具有临床相关性,特别是在抗癌药物设计中,与G4结合的化合物通称为G4配体(G4 ligand)。另一种靶向G4结构的核酸则称为G4适配体(G4 aptamer)。
1.靶向端粒G4结构的配体
考虑到端粒的结构和稳定性与癌症紧密相关,大约80-85%的癌症的端粒酶表达水平均升高,因此端粒G4结构是首个作为癌症治疗靶点的研究对象,下面介绍几种靶向端粒的G4配体:

2.靶向癌基因启动子区G4结构的配体
另一种癌症治疗策略通过使用小配体稳定癌基因启动子区的G4结构来抑制癌基因的表达,包括c-MYC,KRAS,c-KIT,BCL2和VEGF等,下面介绍几种靶向癌基因的G4配体:

3.G4结构的适配体
除药物靶标外,G4结构的核酸也用于开发癌症治疗方法,核酸适配体是单链DNA或RNA序列,能够识别细胞靶标并以高亲和力结合,如蛋白质、小分子、离子,甚至整个细胞,下面介绍几种G4适配体:


G4-ChIP原理图

左图文献报道,右图康测G4-ChIP实例

Peak在基因功能元件的分布 Reads在基因上的覆盖情况

该文献利用G4-ChIP-seq、Pol II ChIP-seq和ATAC-seq,从染色质状态入手,探讨启动子区G4结构的形成和变化情况,结果说明G4结构形成在转录起始之前,并且染色质压缩会导致G4结构的消失。
- 通过G4-ChIP-seq、Pol II ChIP-seq和ATAC-seq确定K562细胞G4结构定位、Pol II结合情况以及染色质可及性状态;
- 分别使用DRB(抑制转录延伸)和TPL(抑制转录起始)处理后,通过G4-ChIP-seq发现G4结构形成不受活跃转录状态影响;
- 利用缺氧处理K562细胞造成染色质状态全局压缩,通过ATAC-seq确认染色质可及性降低,再通过G4-ChIP-seq发现启动子区G4结构大部分消失;同时Pol II ChIP-seq结果显示G4结构启动子区Pol II结合变少;
- 最后通过小分子G4结构稳定剂pyPDS处理,在缺氧状态下维持启动子区G4结构可以保留Pol II在启动子中的结合。
G4-ChIP-seq·G-四链体染色质免疫共沉淀测序
联系我们
地址:武汉市江夏区东湖新技术开发区高新六路99号南山·光谷自贸港A栋6楼
邮箱:seqhealth@seqhealth.cn
电话:027-65527552
热门服务
关注康测公众号











