外泌体测序
细胞会释放大小和细胞内产生来源不同的细胞外囊泡(Extracellular vesicles, EV)。外泌体(Exosome)是一类直径在30-150 nm,由内体(Endosome)产生的小细胞外囊泡 (sEV),几乎所有细胞均会分泌。
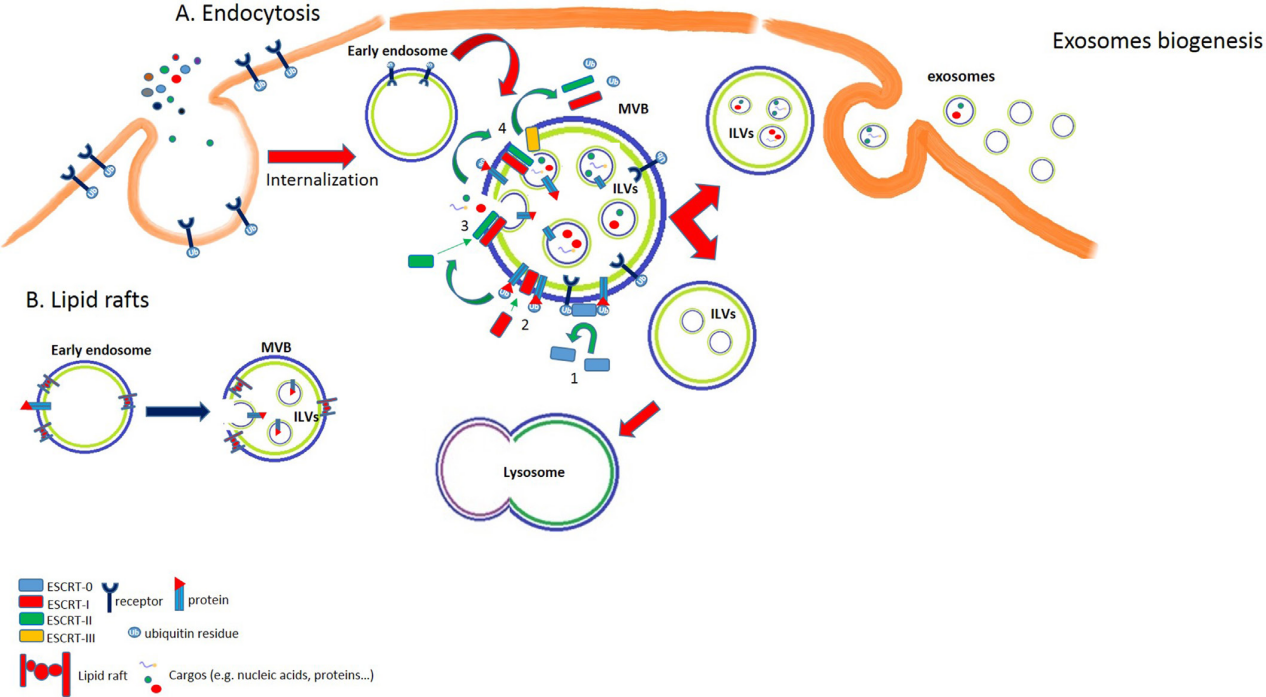
外泌体形成
外泌体形成主要存在两个途径:
- 内吞作用:受体-配体在细胞表面相互作用后,配体与其受体分离并位于早期内体内。相反,受体可以在膜表面循环或通过晚期内体-溶酶体途径部分降解。早期内体随后形成含有腔内囊泡(Intraluminal vesicles, ILV)的多囊泡体(Multivesicular bodies, MVB)。内体分选转运请求复合物 (Endosomal Sorting Complex Request for Transport, ESCRT)负责MVB的形成。
- 脂筏。MVB也可以起源于在其膜上包含特定结构域的内体,称为脂筏。

外泌体分离
外泌体分离方法主要有:
- 差速离心法2. 过滤和超速离心法3. 密度梯度离心法4. 沉淀法5. 免疫亲和捕获和分离法。各方法比较:
- 外泌体得率:4>2>1>3
- 外泌体纯度:3>2=1>4
- 实验周期:3>1>2>4
综合来看,最常用的还是2. 过滤和超速离心法。
外泌体鉴定
根据国际细胞外囊泡学会(ISEV)在2014年的提议,外泌体鉴定有3个标志:电镜照片、粒径分析(Nanoparticle Tracking Analysis, NTA)和蛋白标志物(Western Blot, WB):
- 显微镜方法:a. 透射电镜(TEM)b. 扫描电镜(SEM)c. 冷冻电镜(Cryo-EM)d. 原子力显微镜(AFM)。其中TEM是外泌体鉴定的金标准,外泌体典型电镜照片如下图,一般为茶托型或一侧凹陷的半球形。

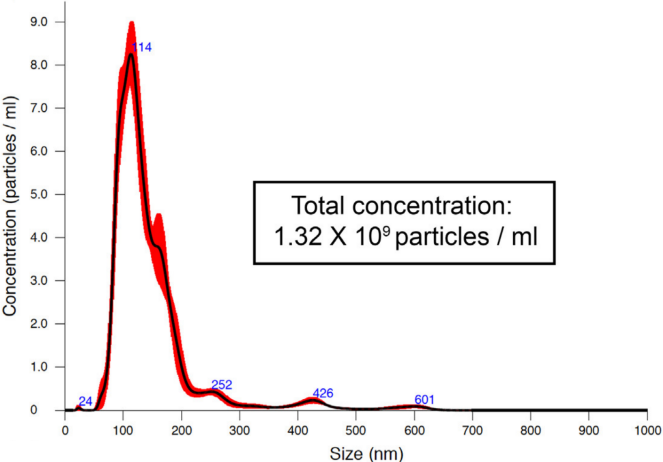
- 粒径和浓度分析
一般外泌体粒径直径主要分布在80-150 nm。

- WB
根据外泌体已报道标志物(左图)进行WB检测(右图)。这些标志物蛋白其实主要是涉及到了囊泡的形成和分泌过程,他们产生于细胞中,定位于胞内的膜结构附近,如四旋蛋白(CD9,CD63和CD81),直接参与了细胞外囊泡内容物的分选;TSG101是ESCRT复合体相关的蛋白,而ESCRT复合体是膜形成和断裂的驱动器。ALIX直接涉及到了膜泡在形成过程中切割脱离质膜形成独立膜结构的过程。




外泌体”货物”


蛋白、RNA、DNA和脂质等物质可以具有选择性地被掺入腔内囊泡(Intraluminal vesicles, ILV)中最后通过外泌体的形式分泌出细胞。鉴定这些分子对于识别某些疾病或肿瘤的生物标志物和未来设计药物干预措施至关重要。这里以RNA分子为例介绍外泌体货物中的RNA种类。
- mRNA:很多文献报道外泌体的前体EV中存在mRNA且可以被翻译并有助于受体细胞的蛋白质表达进程。
- lncRNA:某些lncRNA可能通过目前未知的机制进行选择性分选,其可以在特定细胞条件下调节EV中lncRNA的丰度,影响受体细胞的生物学过程。另外某些RBP-lncRNA复合物特可以捕获特定的miRNA亚群并将它们靶向到EV中。
- miRNA:miRNA可以参与细胞间的信号转导,通过与RNA结合蛋白(RBP)和高密度和低密度脂蛋白结合,并封装在EV中,以避免核解降解(Nucleolytic degradation)过程。因此miRNA可以成为细胞间通讯的新方式以及作为某些疾病和癌症的Biomarker。此外EV中的miRNA还可能与衰老、免疫以及神经系统有关。
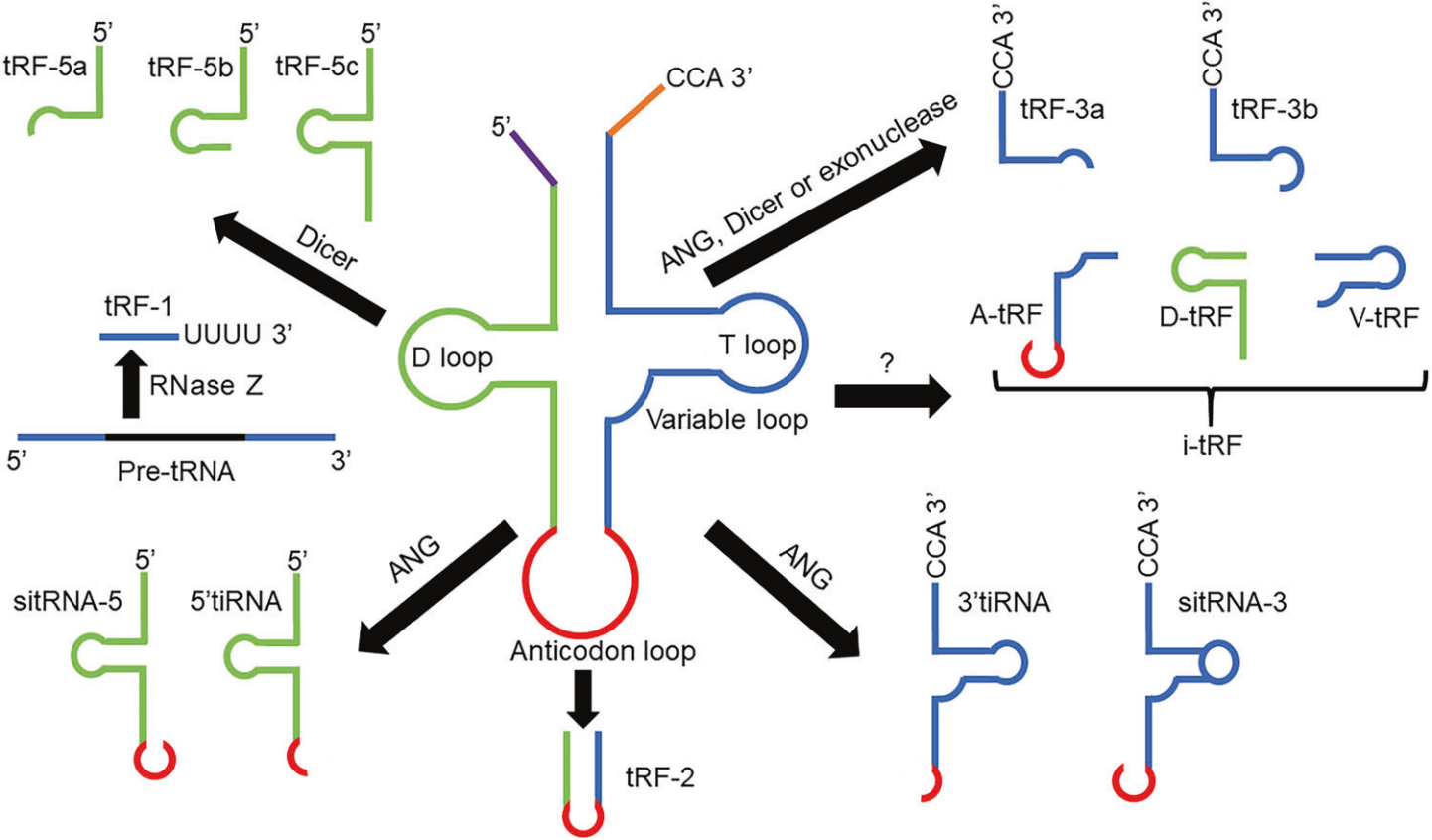
- tRF & tiRNA:tRF分为五个主要亚类:i-tRF、tRF-1、tRF-2、tRF-3和tRF-5。tRF-5起源于成熟tRNA的5'末端,其产生依赖于Dicer酶切割tRNA反密码子环和D环之间的D环或臂茎。根据切割位点,tRF-5分为三种亚型:tRF-5a(14 nt-16 nt)、tRF-5b(22 nt-24 nt)和tRF-5c(28 nt-30 nt)。tRF-3由成熟tRNA的3'末端产生,在TψC环由血管生成素(angiogenin, ANG)、Dicer或核酸外切酶消化。因此在tRF-3尾部,有一个“CCA”三核苷酸,该三核苷酸对该成熟tRNA的 3'末端具有特异性。tRF-3有两种亚型:tRF-3a(18 nt)和tRF-3b(22 nt)。tiRNA是一类在细胞应激条件下通过切割成熟tRNA的反密码子环而产生的,分为5’tiRNA和3’tiRNA,长度在31 nt-40 nt。EV中的tRF & tiRNA主要参与调节表观遗传、基因表达,调控蛋白合成以及免疫激活过程。

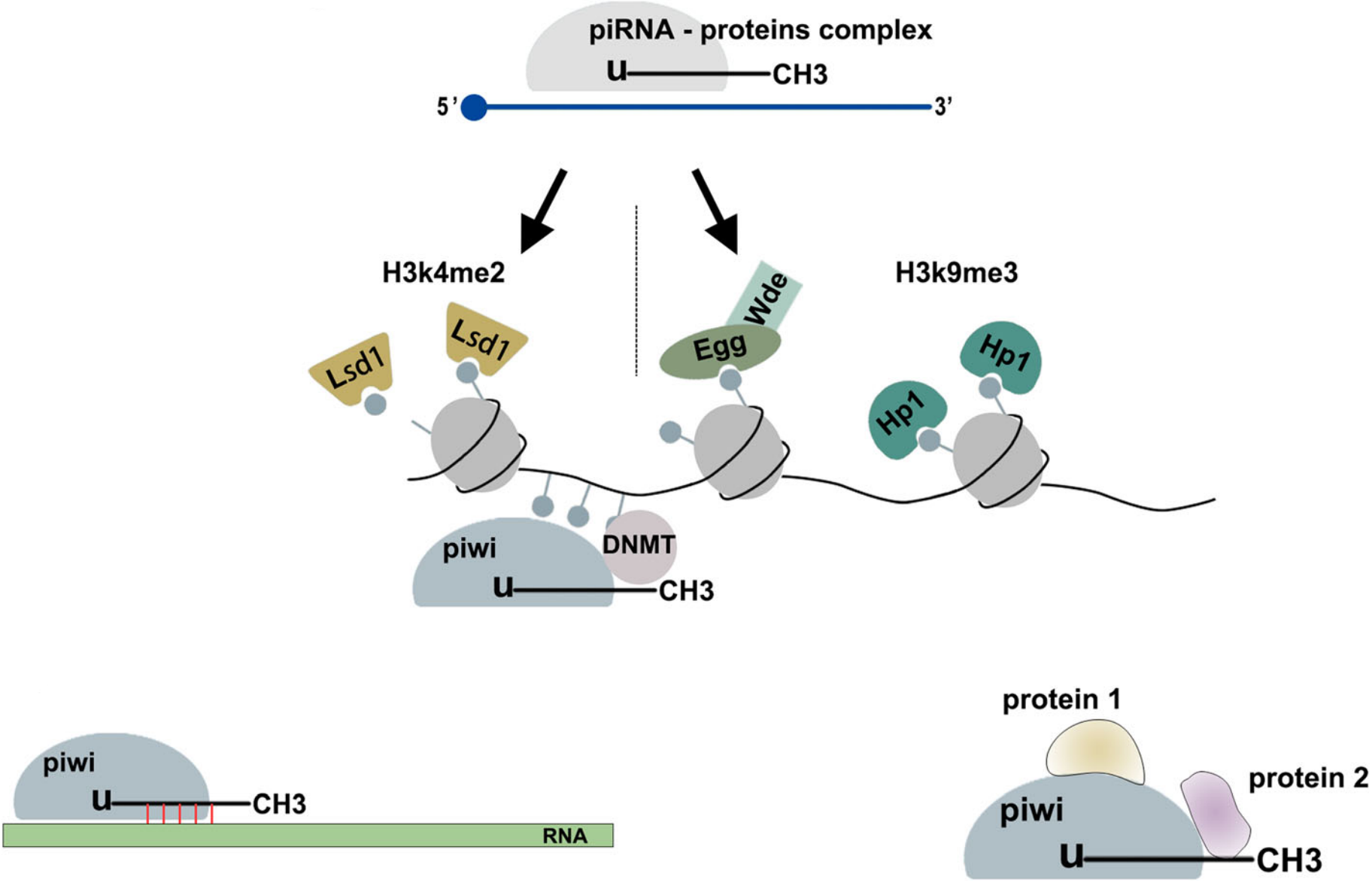
- piRNA:P-element-induced wimpy testis (PIWI) -interacting RNA是一类动物特异性的小沉默 RNA,长度为25-32 nt。piRNA传统意义上的功能是在基因防御方面,例如在性腺细胞中沉默基因组中转座元件(transposable element)靶标。但近期研究表明,piRNA不仅可以发挥传统功能,在各类癌症中可以影响与癌症相关的信号通路,比如piR−55490可以结合Akt/mTOR信号通路中mTOR mRNA的3’UTR区域介导其沉默,因此EV中的piRNA也具有作为各种癌症的生物标志物的潜力。

- circRNA:circRNA在细胞质中可以充当miRNA的分子海绵已经众所周知。目前circRNA在EV中的作用未知,但最近研究结果表明多种癌症的EV中稳定存在circRNA,因此circRNA也具有成为癌症标志物的潜能。
- 其它类型RNA例如rRNA、snRNA、snoRNA等由于关注度不高,不再赘述。
外泌体测序
选择感兴趣的生物分子种类,用对应的组学测序技术完成对外泌体中生物分子种类的鉴定。外泌体中蛋白可以通过蛋白组来鉴定,DNA主要通过重测序或WES方法,这里还是以RNA分子为例介绍如何鉴定相关RNA种类。
- UID Total RNA-seq:UMI分子标签长链建库(链接到RNA-seq),可以获得所有mRNA、lncRNA、circRNA信息,由于外泌体中rRNA完整性不佳,rRNA剔除困难,因此文库中会残留一定比例的rRNA大片段,导致测序数据中rRNA占比相比正常细胞的Total RNA-seq偏高。
- UID miRNA-seq:UMI分子标签短链建库(链接到miRNA-seq),可以获得所有miRNA、tRF、piRNA信息,同长链建库一样,rRNA会以小碎片的形式存在与文库中,导致测序数据中rRNA有一定占比。


外泌体测序文献案例
细胞自噬对肝癌(HCC)进展至关重要,特别是对肿瘤细胞面临的环境应激源的反应,如饥饿、缺氧、生长因子剥夺和抗血管治疗等。近期研究发现肿瘤细胞和宿主以及周围肿瘤微环境(TME)中的自噬可以促进肿瘤的适应、生长和发展以及对治疗的耐药性。前文介绍过外泌体可以成为细胞间通讯的媒介,那么TME中外泌体如何调控肿瘤细胞的自噬过程,作者开展了以下研究:
- 确定表型:提取THLE-2饥饿处理(Exo-Ts)和对照细胞(Exo-T)的外泌体,并与肝癌细胞系Hep3B和Huh-7共培养,WB发现肝癌细胞系自噬蛋白指标LC3B和p62水平升高(图A),说明THLE-2饥饿条件下分泌的外泌体可以增强HCC细胞自噬作用以抵御其面临的饥饿状态;
- 外泌体测序:Total RNA-seq鉴定差异表达的circRNA种类(图B),使用接受TAE(经导管动脉栓塞术)治疗和未接受TAE治疗的临床样本进行qRT-PCR验证(图C),确定候选circRNA:hsa_circ_0005224(circTGFBR2);
- 验证circRNA功能和表型:设计针对circTGFBR2 backsplice位点的siRNA在THLE-2细胞中沉默该circRNA并提取其外泌体,与肝癌细胞系共培养,WB检测自噬指标发现沉默circTGFBR2可以降低外泌体对HCC自噬的增强作用(图D);随后进行自噬表型验证,这里不再展开;
- 确定circRNA靶标:AGO2 RIP-qPCR确定AGO2结合circTGFBR2(图E),说明其充当miRNA海绵的功能;miRanda和RNAhybrid取交集预测circRNA靶标,过表达circTGFBR2只有miR-205-5p表达水平降低,circRNA探针的RNA pull-down验证circTGFBR2和miR-205-5p的结合(图F),后续还有验证实验,这里不再展开;miR-205-5p的抑制剂和mimic验证其对自噬表型的影响;
- 确定miRNA靶标:RNAhybrid、miRanda和TargetScan三者miRNA靶标预测结果取交集,得到候选基因ATG5,HCC和癌旁转录组数据相关性分析发现ATG5表达水平与circTGFBR2呈正相关,与miR-205-5p呈负相关(图G),随后开展验证实验,详见原文;
最后作者回到体内验证CircTGFBR2促进HCC发展和自噬的结果,这里不再展开。

DOI: https://doi.org/10.1038/s41419-023-05989-5











