-
-
-
核心技术 >
检测服务 >
产品/解决方案>
-
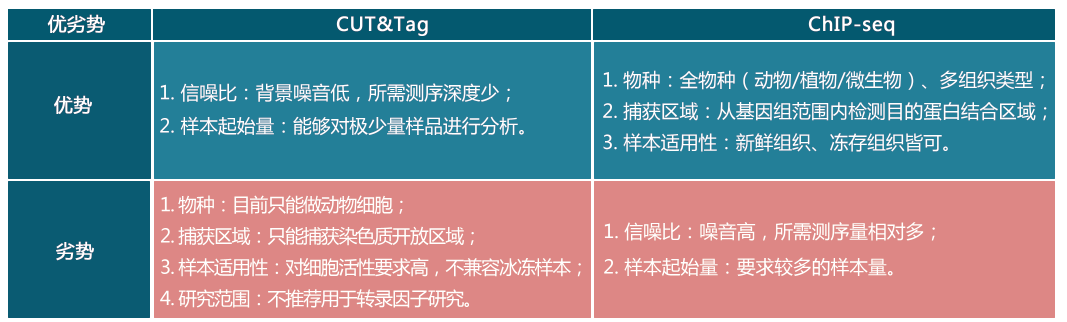
CUT&Tag是“Cleavage Under Targets and Tagmentation”的缩写,是一种用来研究蛋白质和DNA之间的相互作用,并确定目标蛋白质的DNA结合位点的方法,其技术目标和Chip-seq类似。CUT&Tag中,首先使细胞膜具有通透性,然后加入目标蛋白的一抗孵育,进而和二抗孵育,最后加入proteinA-Tn5和测序接头的复合物。Tn5将通过pA-抗体的相互作用定位到靶蛋白上,然后加入Mg2+激活TN5的转座酶活性,通过转座切割目标蛋白周边DNA并将测序接头连接上去。最后经过PCR即可获得测序文库。
您需要提供具有活性的新鲜细胞或新鲜冻存细胞,我们将完成下游的Cut&Tag、测序和生物信息学分析工作!

Nature Communication : CUT&Tag高效分析小样本和单细胞的表观基因组学[1]
本研究对比了ChIP-seq、CUT&RUN、CUT&Tag三种方法检测多种组蛋白修饰、RNAPII、 转录因子、染色质开放性的效果。
1.更高的信噪比


上图:三种方法检测H3K27me3修饰, CUT&Tag检测灵敏且信噪比高
Henikoff等人在对组蛋白H3K27me3进行研究时对比使用了ChIP-seq、CUT&RUN、CUT&Tag三种方法。通过相同的数据量(8M Reads)进行比较分析发现,三种方法对应的染色体景观相似,但是ChIP-seq需要更高的测序深度才能达到去背景噪音的效果,而CUT&Tag有最低的背景噪声和最强的信号。
2.更高的重复性


上图:CUT&Tag的重现性和效率
使用CUT &Tag、CUT & RUN和ChIP- seq三种实验方法(各两种生物学重复)鉴定染色体H3K4me1组蛋白修饰。实验数据证实CUT&Tag的灵敏度最高,实验可重复性最好。
参考文献:
[1] Kaya-Okur HS, Wu SJ, Codomo CA, et al. CUT&Tag for eficient epigenomic profiling of small samples and single cells. Nature Communication,2019 ,10(1):1930.
CUT&Tag
联系我们
地址:武汉市江夏区东湖新技术开发区高新六路99号南山·光谷自贸港A栋6楼
邮箱:seqhealth@seqhealth.cn
电话:027-65527552
热门服务
关注康测公众号