20230217康测科技助力李永翔教授团队徐信博士发表Redox Biology

#
引言
本期带来的是康测科技金牌ChIP-seq和RNA-seq联用的客户文献,该文献主要探讨ATF2在胃癌和胃癌细胞铁死亡过程中的作用,其中ChIP-seq帮助客户找到ATF2调控的靶标HSPH1。
#
背景
索拉非尼(Sorafenib)是一种酪氨酸激酶抑制剂,作为铁死亡诱导剂在包括胃癌(GC)在内的多种癌症中具有重要的抗肿瘤作用。铁死亡是一种新型的程序性细胞死亡形式,其特征在于脂质过氧化产物以细胞铁依赖性方式积累,抑制胱氨酸/谷氨酸转运蛋白(SCL7A11或xCT)和谷胱甘肽过氧化物酶4(GPX4)是诱导铁死亡的最常见方法。索拉非尼通过抑制xCT限制胱氨酸输入,引起内质网应激、谷胱甘肽耗竭和脂质活性氧(ROS)的铁依赖性积累,最终诱发铁死亡。近期有研究表明索拉非尼作为铁死亡诱导剂作用受到质疑,索拉非尼是否真的可以诱导GC细胞中的铁死亡以及潜在的分子机制仍然在很大程度上处于未知状态。
ATF2是ATF/CREB转录因子(TFs)家族的成员,与广泛的癌症相关生物学功能有关,如细胞增殖、凋亡和DNA修复。尽管已有多项研究报道了ATF2在GC中的致癌作用,但仍缺乏体内体外实验证据,尤其是其与临床病理参数和预后的关系。在这篇文章中,作者探讨ATF2在索拉非尼诱导的GC铁死亡中的作用和分子机制,让我们一起看看吧。
#
研究内容
1. ATF2表达水平在GC中上调并预示着不良预后
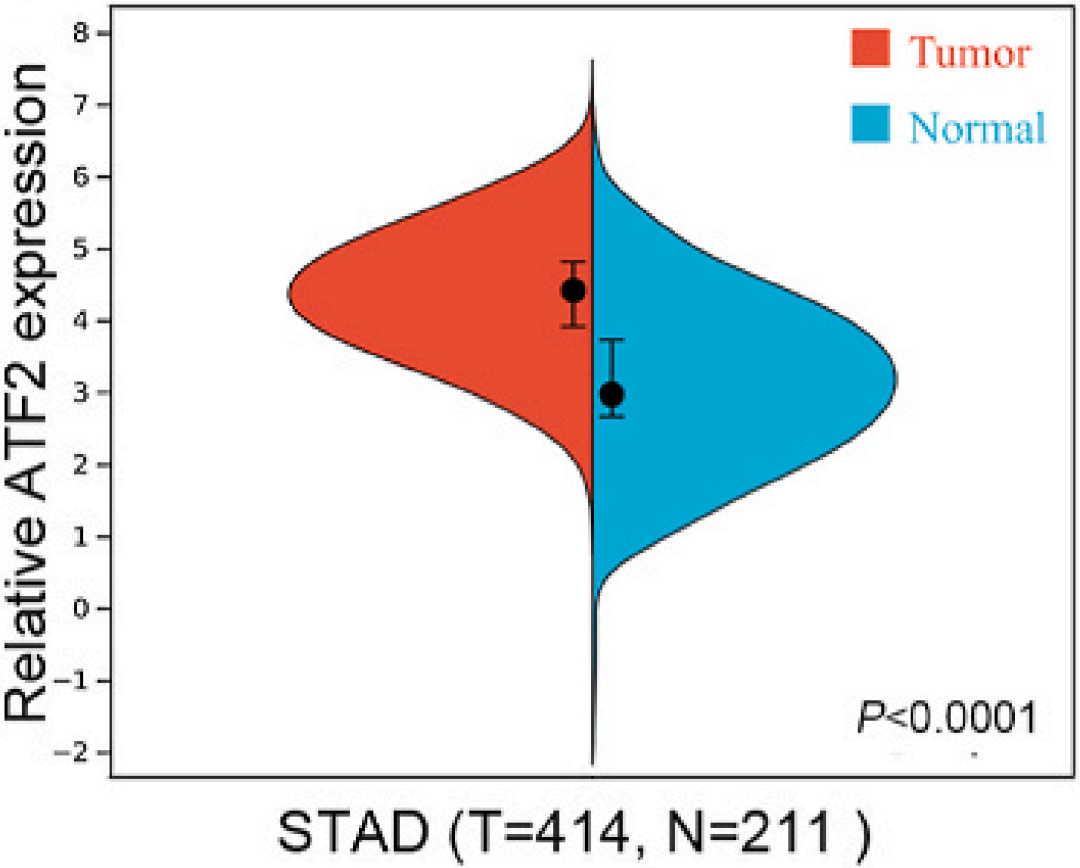
作者首先利用TCGA数据库中调查ATF2的表达水平,结果显示ATF2 mRNA在GC细胞系中表达水平明显高于非癌细胞系(下图)。
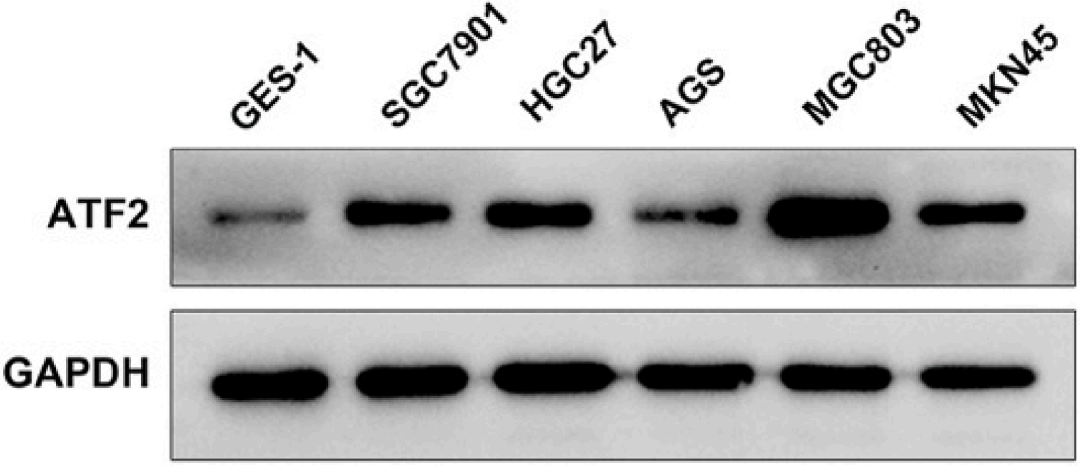
WB结果显示GC细胞系(SGC7901、HGC27、AGS、MGC803和MKN45)ATF2蛋白水平也明显高于非癌细胞系GES-1(下图)。
下一步分析ATF2表达水平与临床病理学参数的关系,结果显示结ATF2表达水平上升与肿瘤淋巴结转移(P=0.003)和远端转移(P =0.034)显著相关(下表)。

此外,总生存期(OS)分析表明,ATF2表达水平升高的GC患者生存时间比ATF2表达水平降低的患者更短(下图)。KM绘图数据库中同样显示大队列患者中高水平表达ATF2的GC与不良预后有关(下图右)。
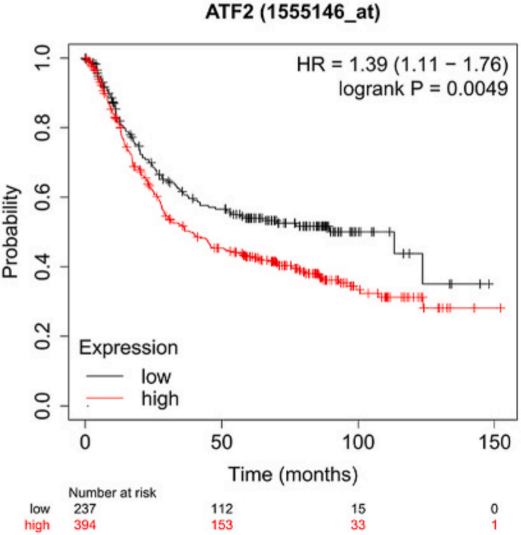
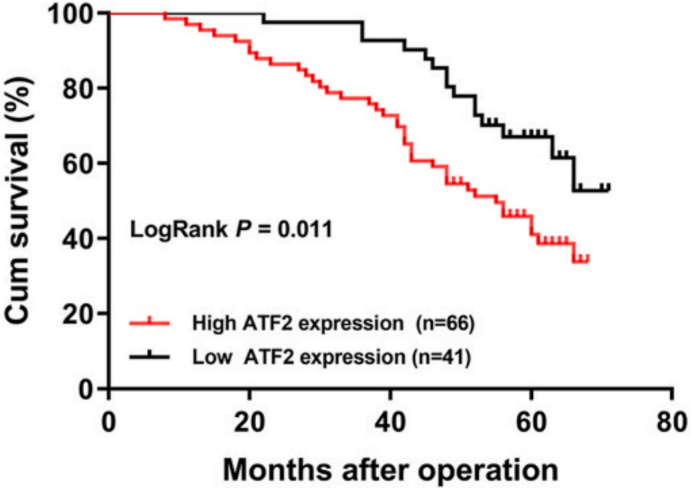
总的来说,这些结果表明ATF2表达在GC中上调而且是不良预后的标志。
2. 敲低ATF2表达水平可以抑制GC细胞的恶性表型
作为不良预后的标志,作者首先将MGC803细胞系中ATF2敲低,并在AGS细胞系中过表达ATF2。CCK-8测定结果显示,尽管过表达ATF2没有观察到明显变化,但敲低ATF2显着降低了细胞增殖能力(下图)。
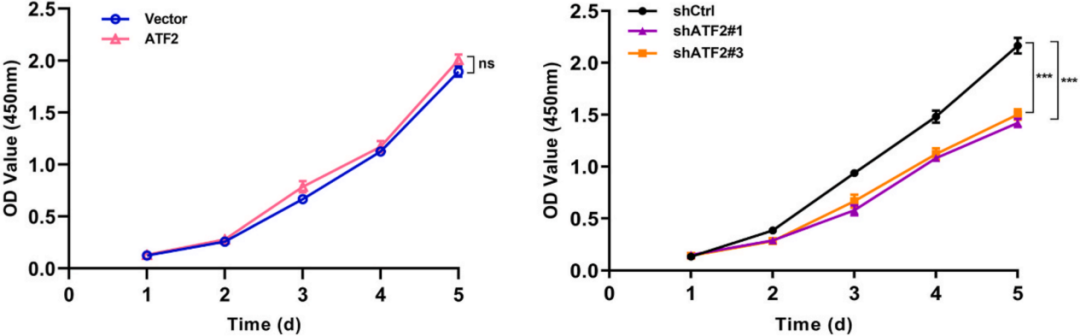
虽然对细胞增殖能力没有影响,但过表达ATF2可以增强GC细胞的迁移能力,而侵袭能力没有改变(下图)。
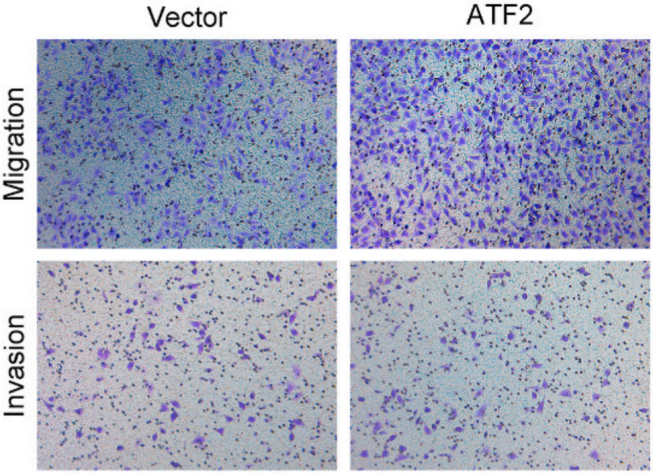
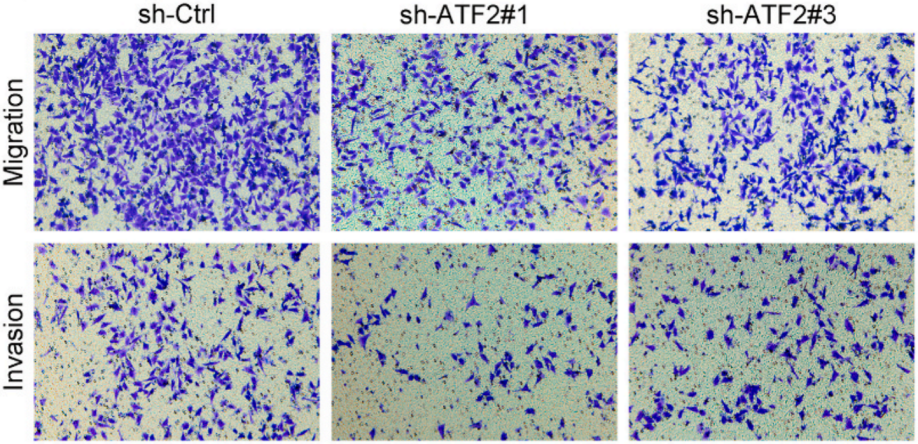
敲低ATF2可以显着减弱GC细胞的迁移和侵袭能力(下图)。
这些结果共同说明敲低ATF2可以减弱GC细胞恶性表型,其影响比过表达ATF2作用更大。
3. 索拉非尼诱导铁死亡并激活GC细胞中ATF2的表达
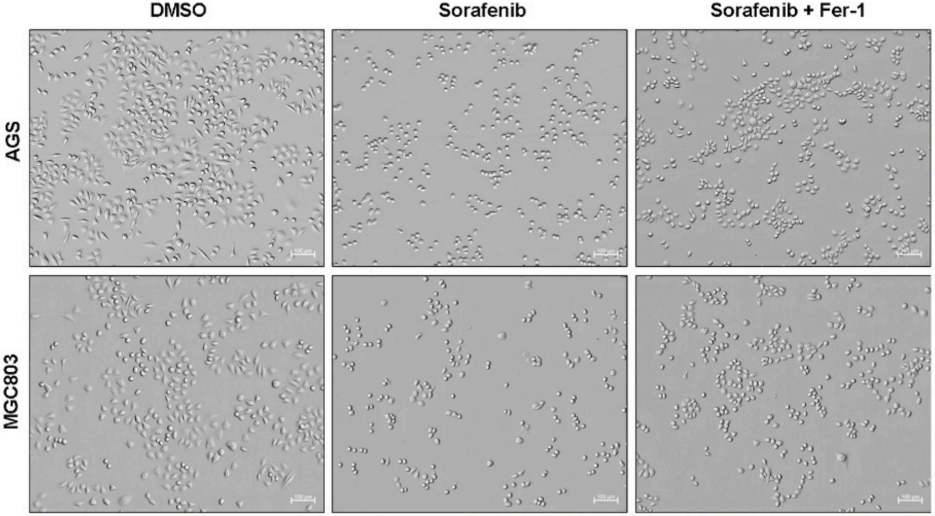
由于先前的一项研究表明索拉非尼诱导的铁死亡存在不确定性,作者首先研究索拉非尼是否可以诱导GC细胞的铁死亡过程。使用10 μM索拉非尼处理24小时后,AGS和MGC803细胞的形态均缩小,变为圆形且排列松散(下图)。相对于未处理的GC细胞,索拉非尼处理可以降低细胞增殖速率,而与铁死亡抑制剂(Fer-1)的共同处理可以部分逆转这些变化。
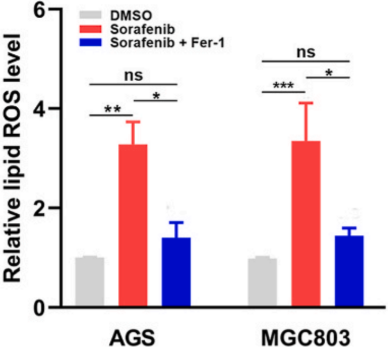
与对照组相比,索拉非尼处理导致细胞总ROS和脂质ROS含量增加(下图)。
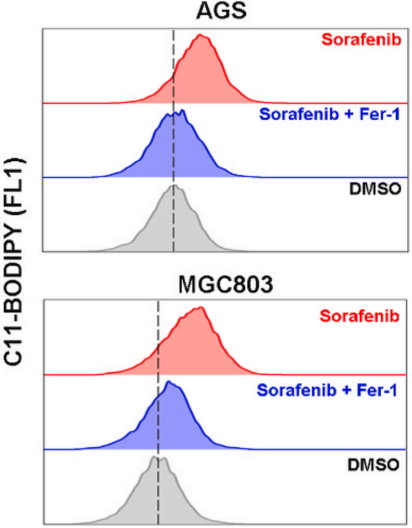
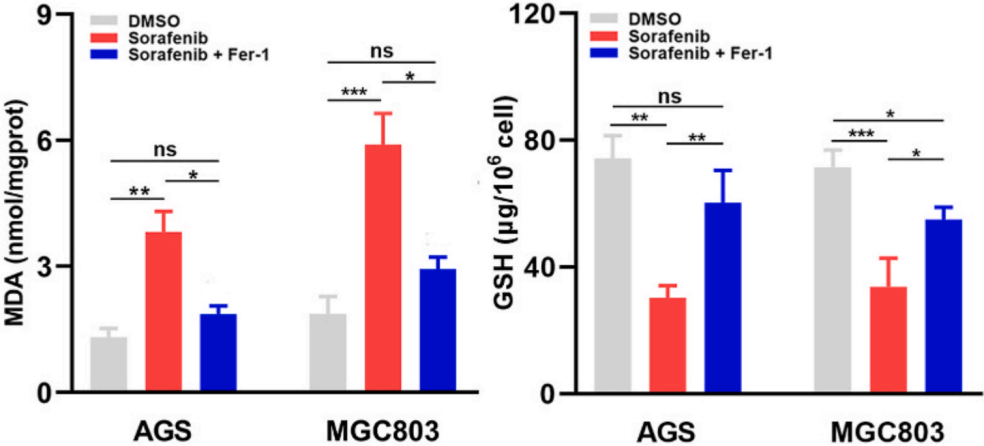
此外,索拉非尼处理可以导致MDA含量急剧增加,但GSH含量降低,而且这种结果可以被铁死亡抑制剂(Fer-1)所抑制(下图)。
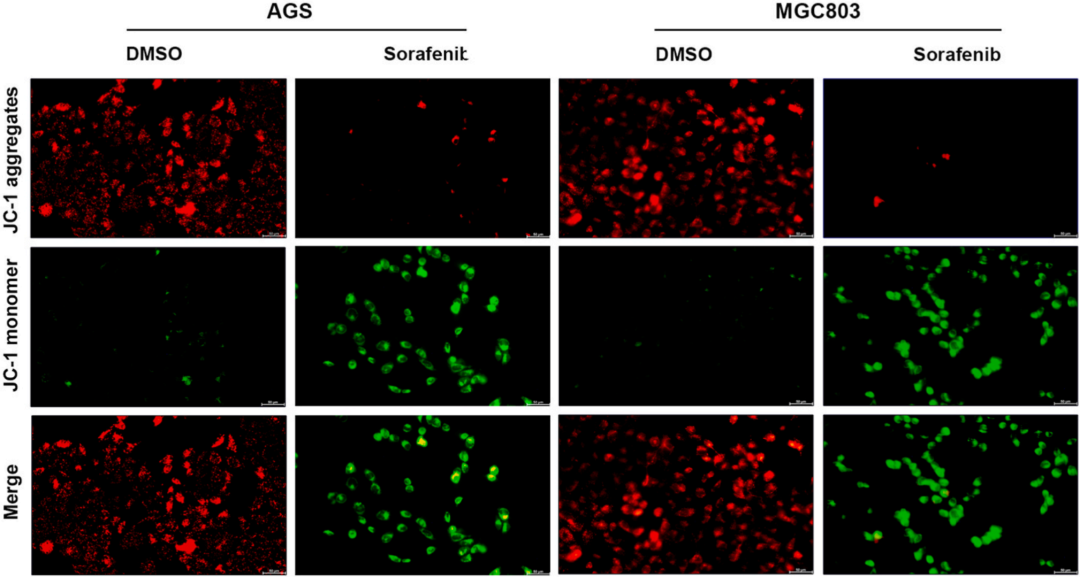
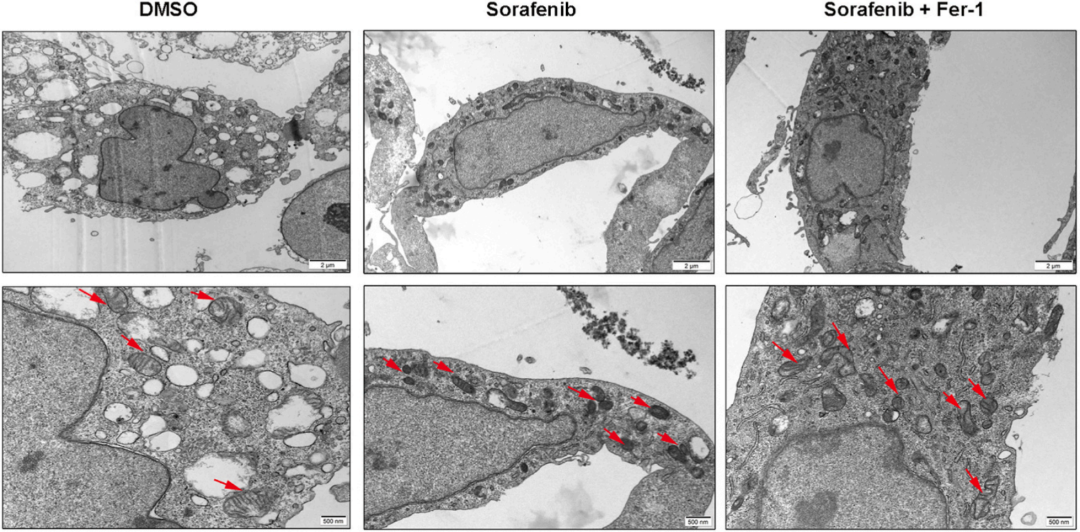
由于铁死亡过程与线粒体功能密切相关,通过JC-1染色发现索拉非尼处理后线粒体膜电位(MMP)显著降低(下图上)、TEM照片显示线粒体膜密度增加,线粒体嵴明显减少(下图下)。这些结果说明索拉非尼可以诱导GC细胞的铁死亡过程。
ATF2作为关键应激反应转录因子,在索拉非尼处理后蛋白水平明显上升(下图左),而免疫荧光染色显示其更多的分布在细胞核内(下图右),说明索拉非尼诱导铁死亡可以增强GC细胞中ATF2的转录活性。

4. ATF2在索拉非尼诱导的GC细胞铁死亡过程中的功能?
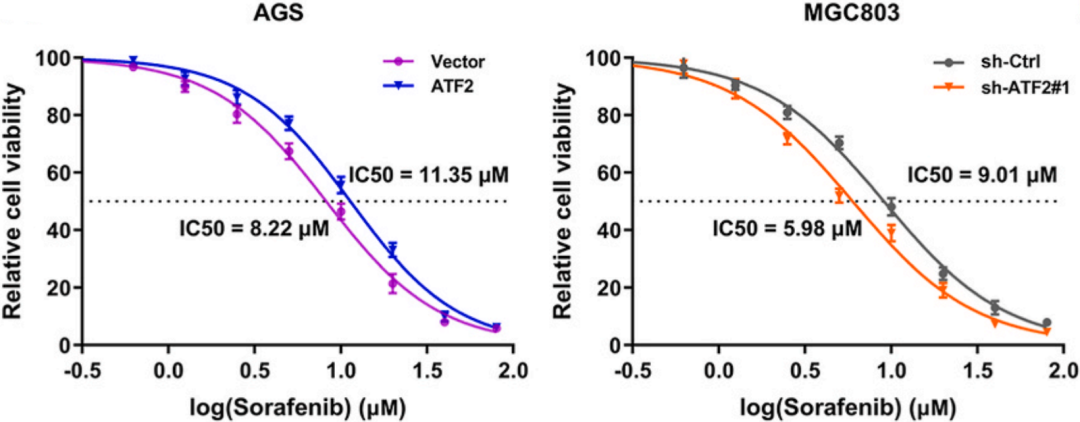
为了理解ATF2在索拉非尼诱导的铁死亡过程中的作用,最简单的就是敲低/过表达,通过CCK-8试验,作者发现ATF2过表达可以导致AGS细胞中索拉非尼的IC50值增加并促进GC细胞生长,而ATF2敲低诱导MGC803细胞中索拉非尼的IC50降低并抑制GC细胞生长。
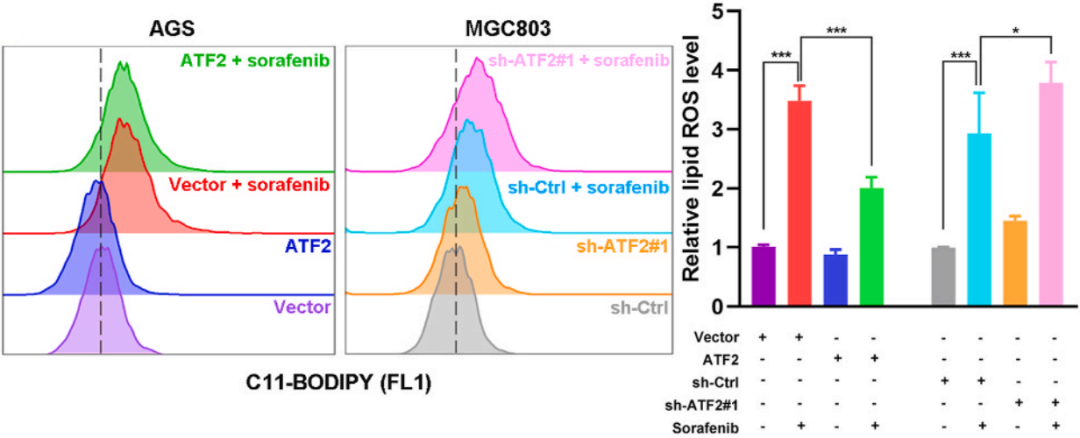
此外,索拉非尼处理和敲低ATF2均可以升高总细胞ROS和脂质ROS含量,敲低ATF2可以导致AGS细胞ROS含量进一步增加,而ATF2过表达可以抑制MGC803细胞中索拉非尼诱导的ROS含量增加(下图)。
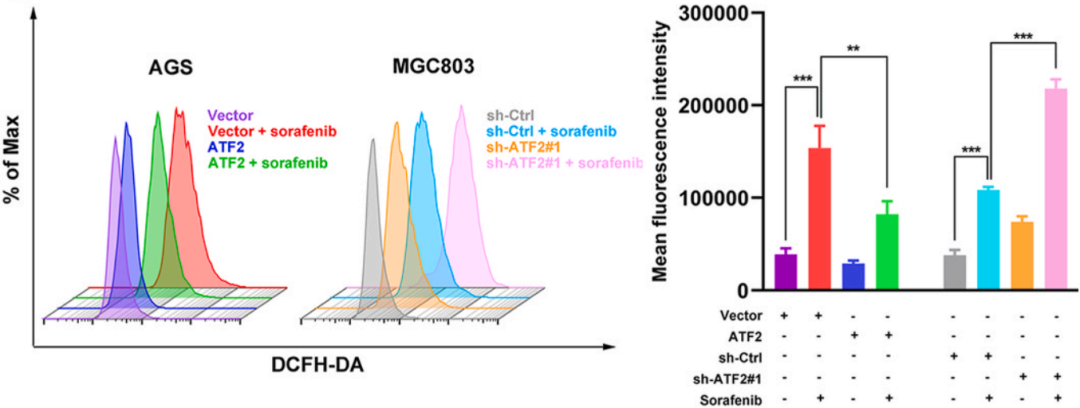
这些结果说明ATF2表达水平升高可以抑制索拉非尼诱导的铁死亡过程,反之则促进铁死亡过程。
5. 进一步确定ATF2调控靶标
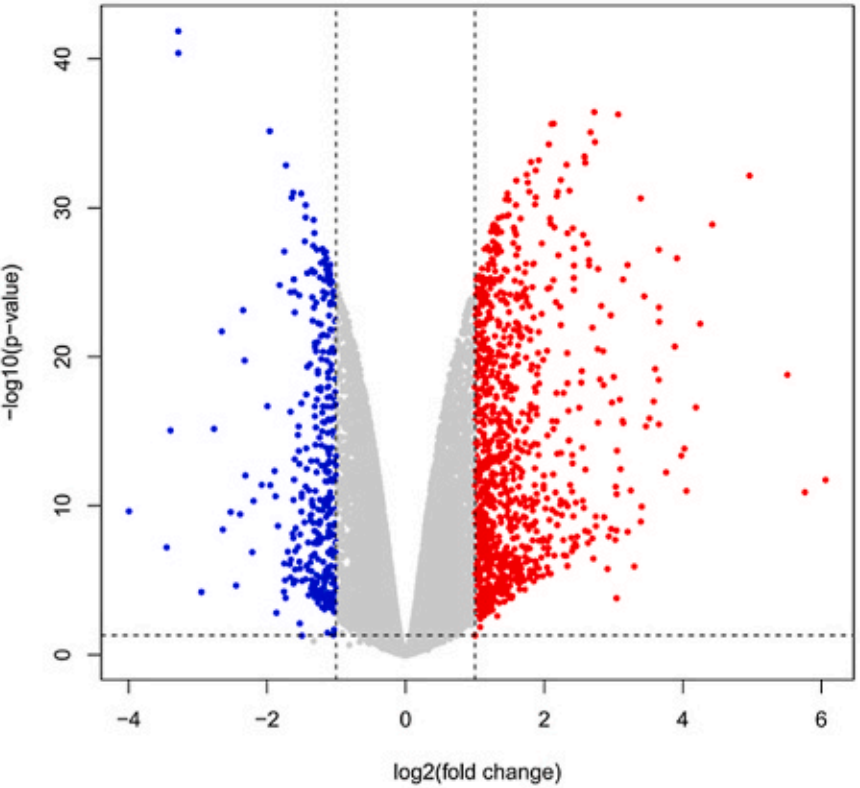
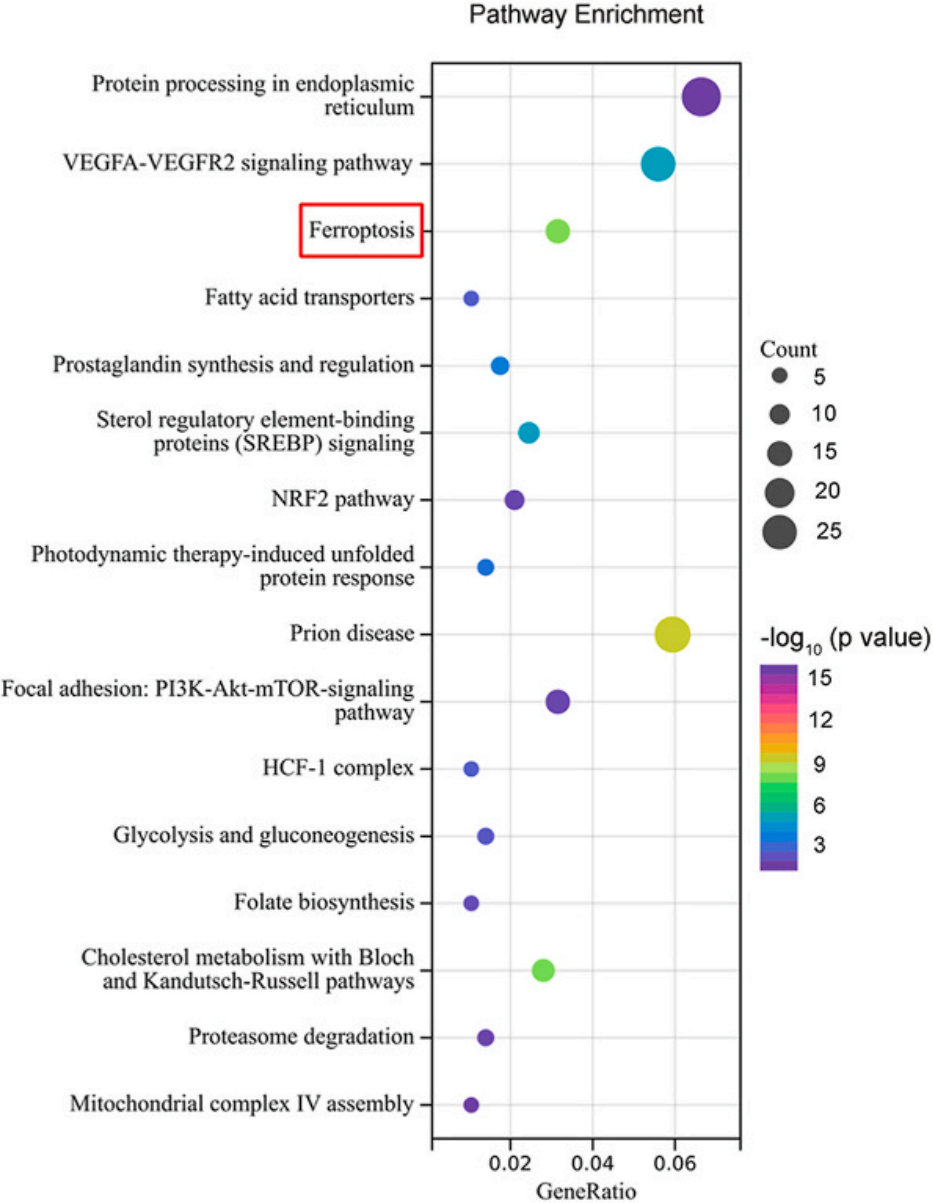
了解ATF2在铁死亡的功能后,进一步揭示其作用机制离不开ChIP-seq,作者在康测科技进行ATF2 ChIP-seq和RNA-seq。作者首先展示RNA-seq差异基因数量(下图上),KEGG分析显示敲低ATF2后出现的差异基因富集在铁死亡通路(下图下)。
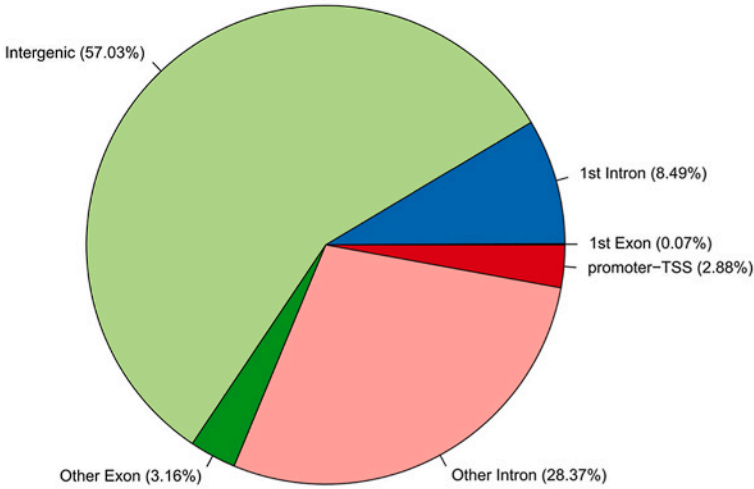
随后展示ChIP-seq结果,主要是Peak在基因功能区的占比(下图)。
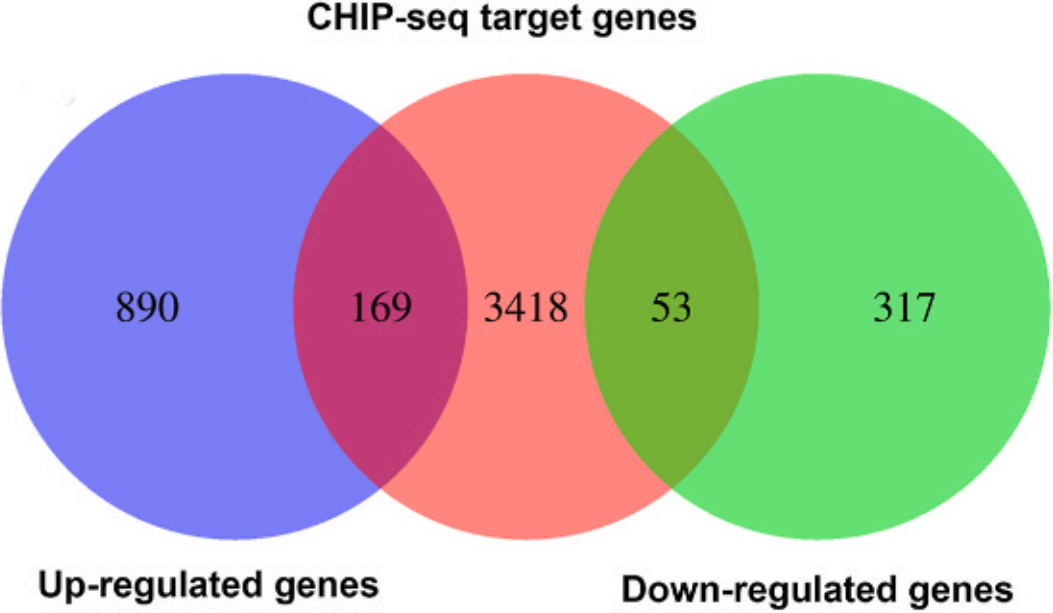
ChIP-seq+RNA-seq联合分析获得ATF2调控的候选靶标(下图),并从中挑选出敲低ATF2后表达水平下调最明显的HSPH1(下图)。
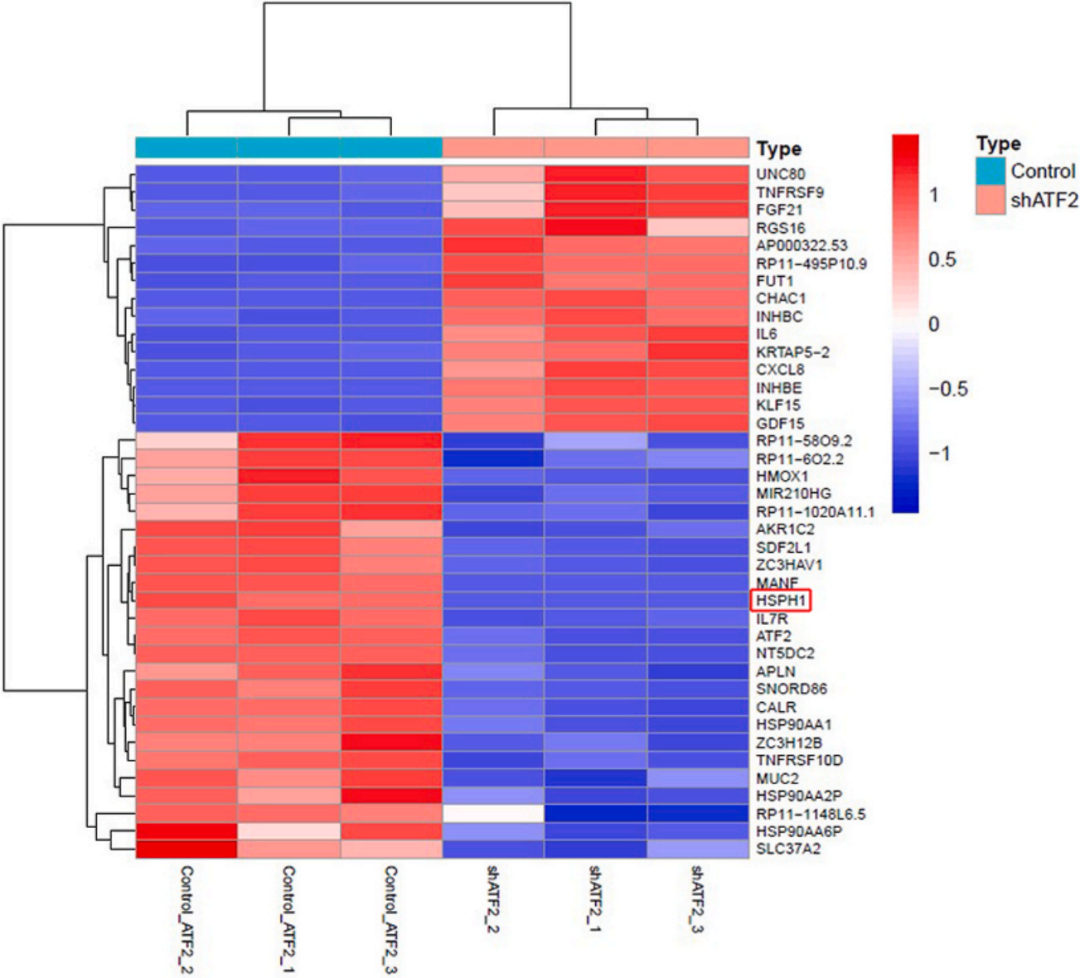
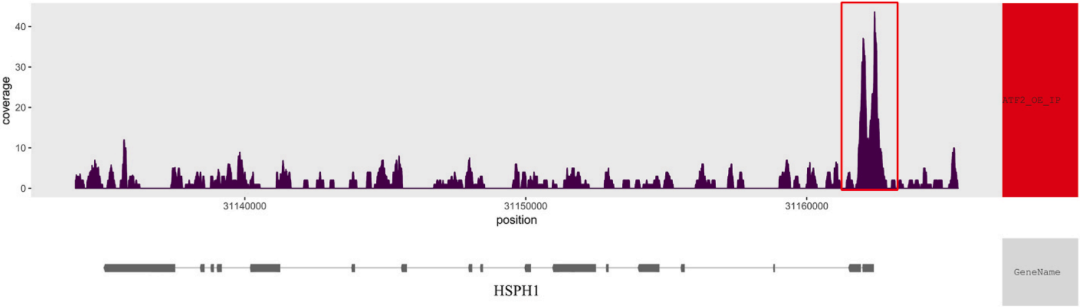
从基因Coverage图可以看到ATF2结合在HSPH1的启动子区(下图)。
为了验证HSPH1是ATF2的靶标,WB结果显示HSPH1蛋白水平随着ATF2过表达和敲低而上升和下降(下图左);ChIP-qPCR结果显示ATG2可以结合HSPH1的启动子区(下图右),这些结果说明HSPH1是ATF2的靶标。

6. HSPH1在GC细胞铁死亡中的角色
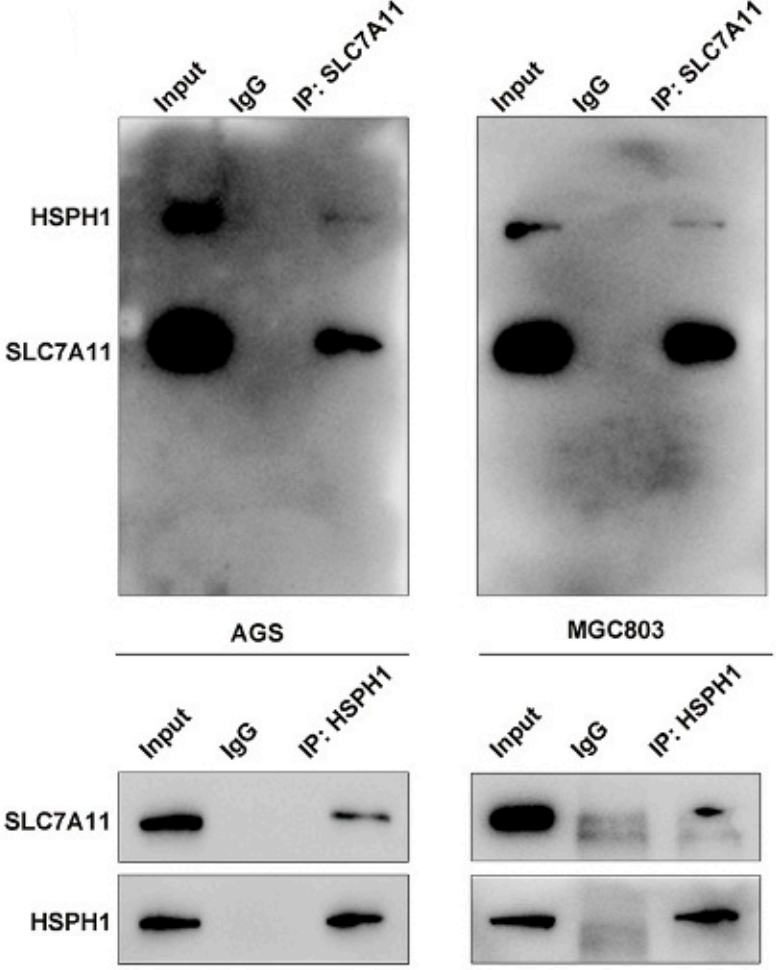
考虑到HSPH1是热休克蛋白家族中的一员,可以是某些功能蛋白的分子伴侣,加上之前文献报道HSP家族在铁死亡中的作用,作者挑选SLC7A11作为HSPH1的靶标蛋白并开展了验证。首先使用Co-IP验证了HSPH1可以和SLC7A11在物理上互作(下图)。
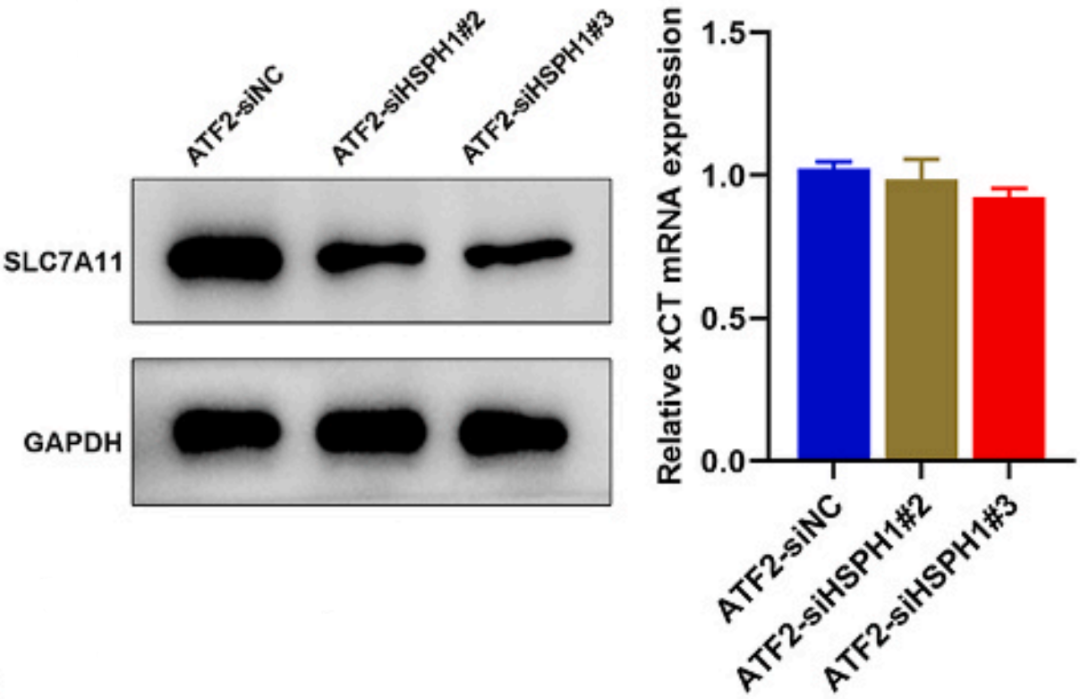
接下来在过表达ATF2的AGS细胞中敲低HSPH1,结果显示SLC7A11蛋白水平降低而不是mRNA水平(下图)。
随后进行CHX追踪试验来确定sLC7A11蛋白的半衰期,WB结果显示敲低HSPH1可以致使SLC7A11蛋白加速降解(下图)。
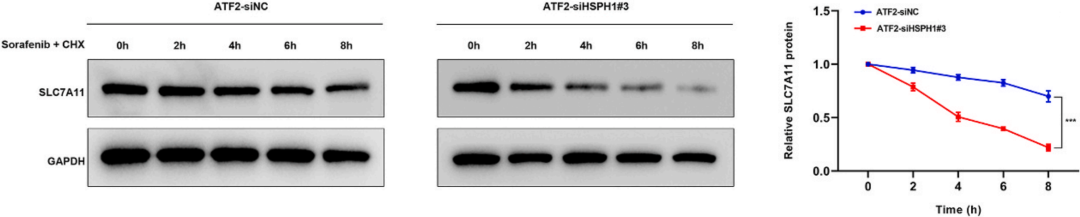
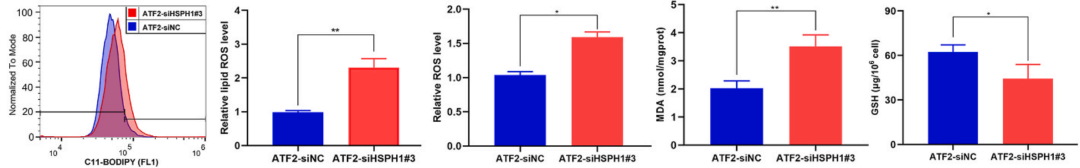
针对铁死亡的指标ROS、MDA和GSH水平,敲低HSPH1可以降低这些指标的含量(下图),这些结果说明GC细胞索拉非尼诱导的铁死亡过程是由ATF2调控HSPH1表达水平来完成的。
最后作者在体内验证敲低ATF2可以增加GC对索拉非尼的敏感性,这里就不再展开。
#
总结
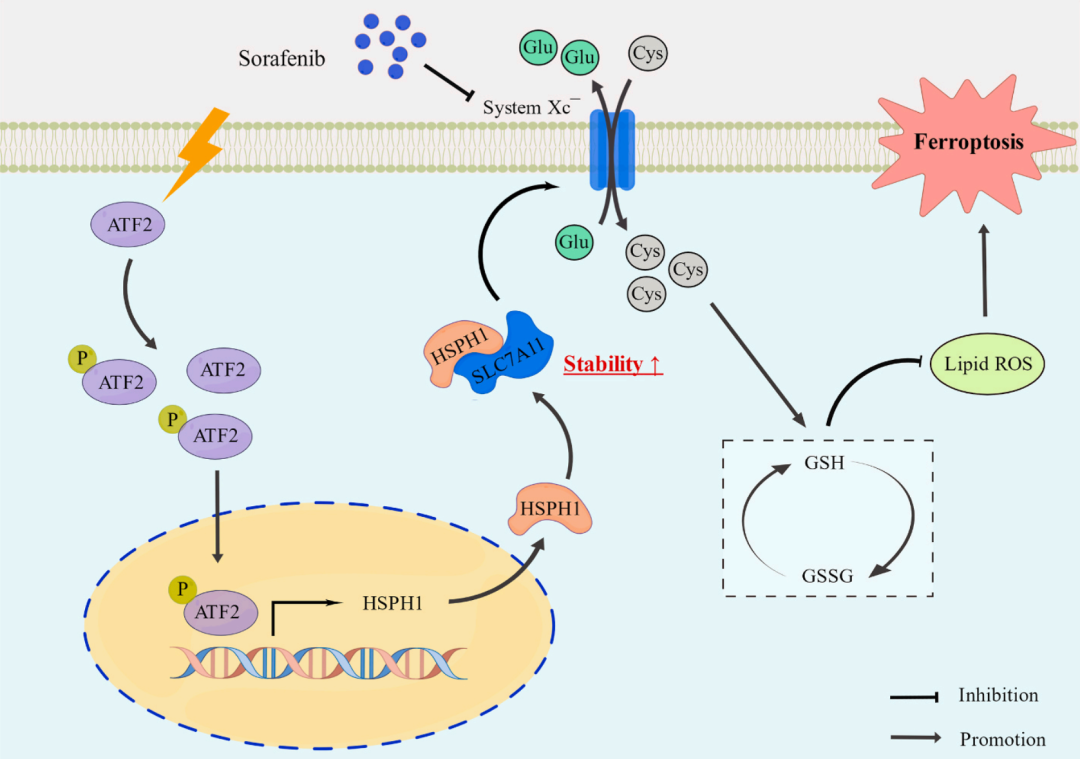
该文献从ATF2在GC表达异常入手,并证明了索拉非尼可以诱导GC铁死亡,随后讨论ATF2在索拉非尼诱导GC铁死亡过程中的作用,随后在康测科技进行ATF2 ChIP-seq和RNA-seq,找到ATF2调控的靶标HSPH1,并验证HSPH1的在铁死亡过程中的功能,让我们总结下作者的工作:
1. 根据TCGA数据发现GC相比癌旁ATF2表达上调;敲低ATF2可以抑制GC细胞的迁移和侵袭能力;
2. 体外验证索拉非尼可以诱导GC细胞铁死亡过程,并在过程中激活ATF2的表达;
3. 敲低/过表达确认ATF2表达水平升高可以抑制铁死亡过程,反之抑制;
4. 通过ChIP-seq+RNA-seq确认ATF2的调控靶标HSPH1;
5. Co-IP验证HSPH1可以结合靶标SLC7A11,过表达ATF2细胞中敲低HSPH1可以加速SLC7A11的降解。
#
参考文献
Xin Xu, Yaxian Li, Youliang Wu, et al. Increased ATF2 expression predicts poor prognosis and inhibits sorafenib-induced ferroptosis in gastric cancer. Redox Biology, Volume 59, 2023.
DOI: 10.1016/j.redox.2022.102564
#
拓展阅读











