20230203 国自热点研究调节T细胞,TCR-seq不可或缺

#
引言
免疫系统是我们人体对抗外来病原,内源肿瘤的手段。非特异性免疫是第一道屏障,但真正起决定性作用的是特异性免疫。特异性免疫研究绕不开B细胞和T细胞,那么如何追踪B细胞和T细胞的种类、分布情况和功能呢?本次带来的NC文章系统性的分析乳腺癌患者T细胞的种类、分布情况和功能,并通过TCR-seq首次证明体内外周血常规T细胞可以诱导形成调节T细胞,因为两者共享相同的TCR序列。
#
背景
对于人乳腺癌来说,区域性淋巴结(LN)通常是肿瘤转移的第一个部位。从临床角度来看,肿瘤引流淋巴结(TDLN)的肿瘤浸润是疾病发展的重要步骤,是复发风险和生存率低的预后指标。从免疫学的角度来看,对肿瘤转移和LN免疫功能的影响知之甚少。考虑到肿瘤会产生广泛的免疫抑制机制,那么在肿瘤扩散过程中TDLN的侵袭是否会产生免疫抑制细胞,比如FOXP3+ CD4+调节T细胞(Treg)的积累,并赋予肿瘤耐受的微环境呢?
表达转录因子FOXP3的Treg维持免疫系统的自我耐受性和稳态,但同时也会抑制抗肿瘤免疫。Treg和常规T细胞(Tconv)之间的数量平衡决定了免疫反应的结果。Treg具有高度异质性,可以由胸腺产生,也可以来源于外周血中的Tconv。免疫检查点的免疫治疗阻断,如PD-1/PD-L1和CTLA-4,已经成功应用于多种癌症。因此,考虑到检查点阻断抗体不仅可以在肿瘤床的效应T细胞期中起作用,还可以在TDLN中的T细胞启动期间起作用,因此了解T细胞(包括Treg)的免疫状态非常重要,检查点阻断抗体也可以靶向这些T细胞。
作者对Tregs在肿瘤浸润(I)TDLN、非浸润(NI)TDLN原发性管腔乳腺癌(T)中的表型和功能进行综合分析,让我们看看作者做了哪些工作吧。
#
研究内容
1. 肿瘤浸润的TDLN中聚集真正的记忆Treg
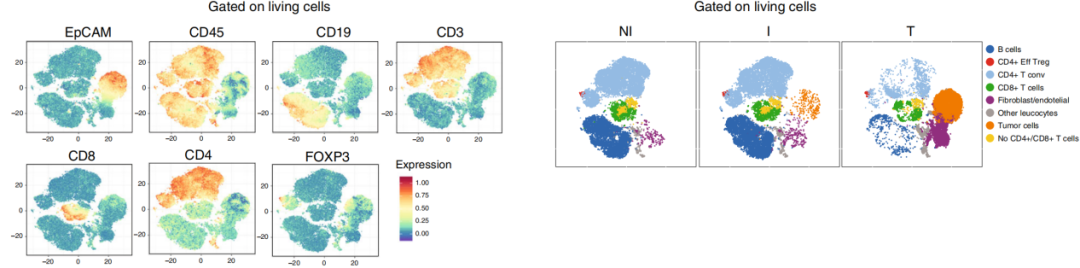
作者首先对刚切除的NI和I TDLN以及接受标准手术切除的管腔乳腺癌患者的原发性肿瘤进行了FACS分选肿瘤细胞和免疫细胞(如下图)。

TDLN根据有无转移的肿瘤细胞(EPCAM+, CD45-)分为NI和I。使用非监督聚类将分选出的细胞进行聚类,主要有的细胞类型是:B细胞、Tconv、Treg、CD8+ T、肿瘤细胞等,如下图。
作者进一步将Treg根据FOXP3和CD45RA的表达进一步分类:a. 初生Treg;b. 效应Treg(Eff Treg);c. FOXP3+ non-Treg(刚被激活的Tconv);d. 记忆Tconv;e. 初生Tconv,如下图。结果显示相比NI,I TDLN中具有更多的Eff Treg,而初生Tconv的比例较低。在肿瘤组织中,CD4+ T细胞具有非常低比例的初生细胞和相对较高比例的Eff Tres和记忆Tconv细胞。
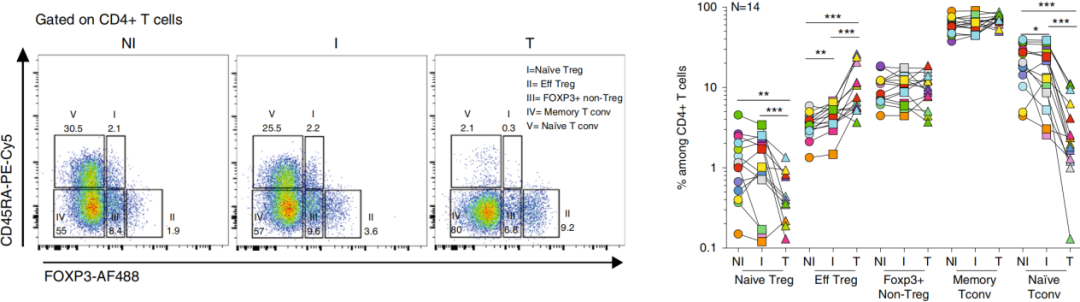
这些结果致使作者推测TDLN中的肿瘤细胞:a. 可能被初生Treg/Tconv识别后,接着变成Eff Treg细胞表型;或b. 可能参与从肿瘤循环到TDLN的Eff Treg的积累。
2. TDLN中Treg表达不同的免疫检查点分子
由于初生T细胞检测不到免疫检查点分子的表达,作者主要检测记忆T细胞。在三个组织类型中,大部分Treg表达共抑制受体PD-1和CTLA-4和共刺激受体ICOS和GITR,下图。

I TDLN中更多Treg表达ICOS、GITR、OX40和PD-1,如下图。
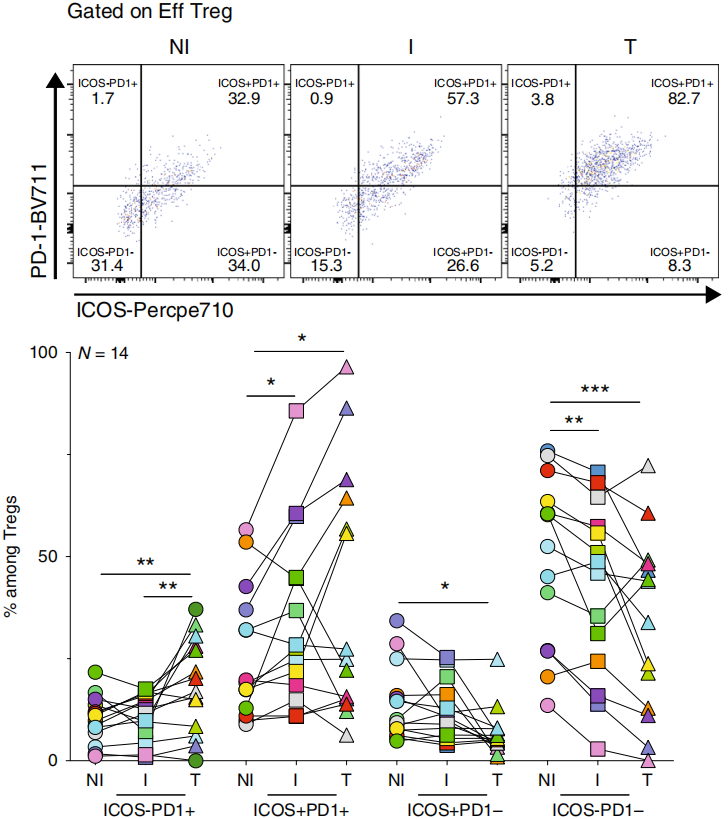
在肿瘤组织中,更多的Treg表达各免疫检查点分子,如下图。
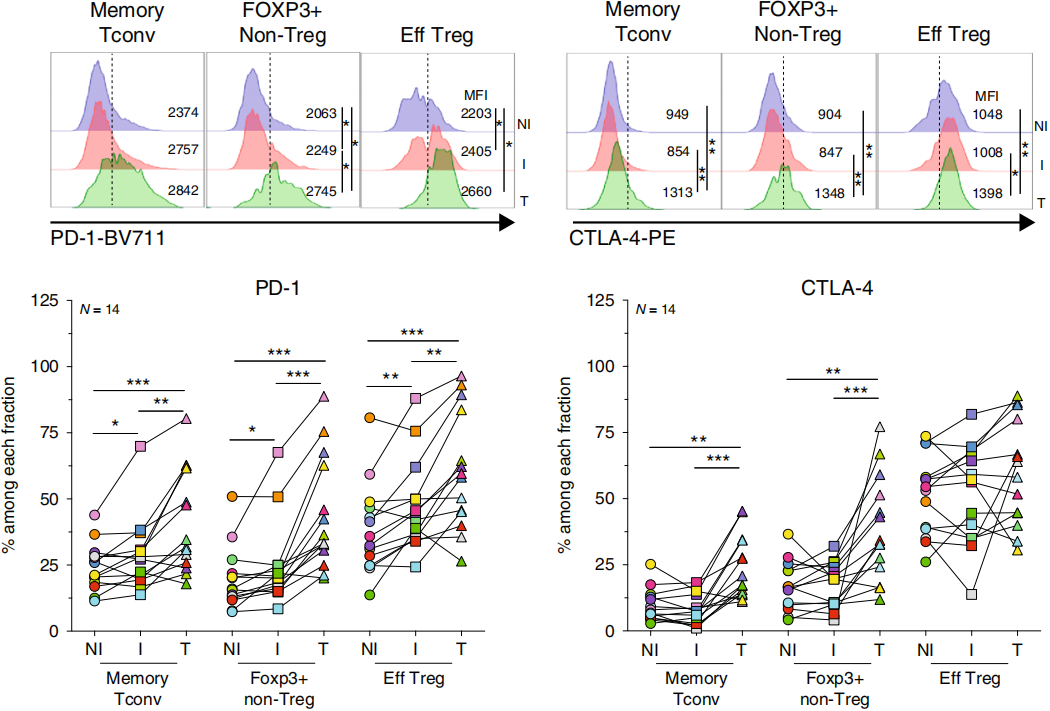
这些结果说明肿瘤细胞的存在,更高比例的Treg细胞发生激活并表达免疫检查点分子,并且再次证明在TDLN中这些免疫检查点抗体不仅可以针对效应期,还能针对起始期。
3. TDLN和肿瘤组织中Treg行使保守的免疫抑制功能
考虑到Treg在促炎症反应微环境的情况下可以展现不稳定的表型从而失去免疫抑制功能,作者检查了NI、I TDLN和肿瘤组织是否处于促炎症或抗炎症反应的微环境中。刺激来自三种组织的离体全细胞悬浮液并分析T细胞增殖,结果显示来自NI和I TDLN的Tconv高度增殖,然而来自肿瘤组织的Tconv在几个细胞周期后停止分裂。
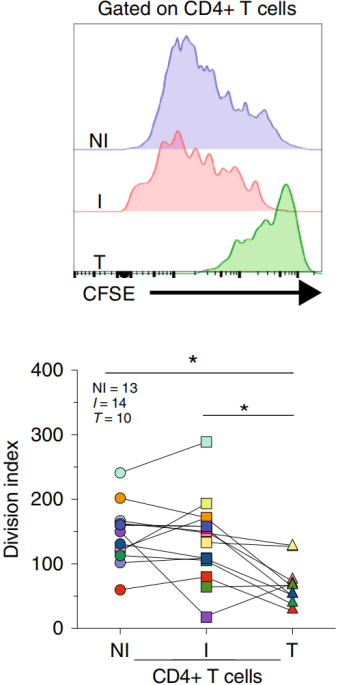
为了评估来自I TDLN的Treg(其中Tconv更有利于炎症反应)是否保持其抑制功能,作者进行了经典的抑制测试,结果显示来自I TDLN和肿瘤的Treg具有抑制功能,如下图。
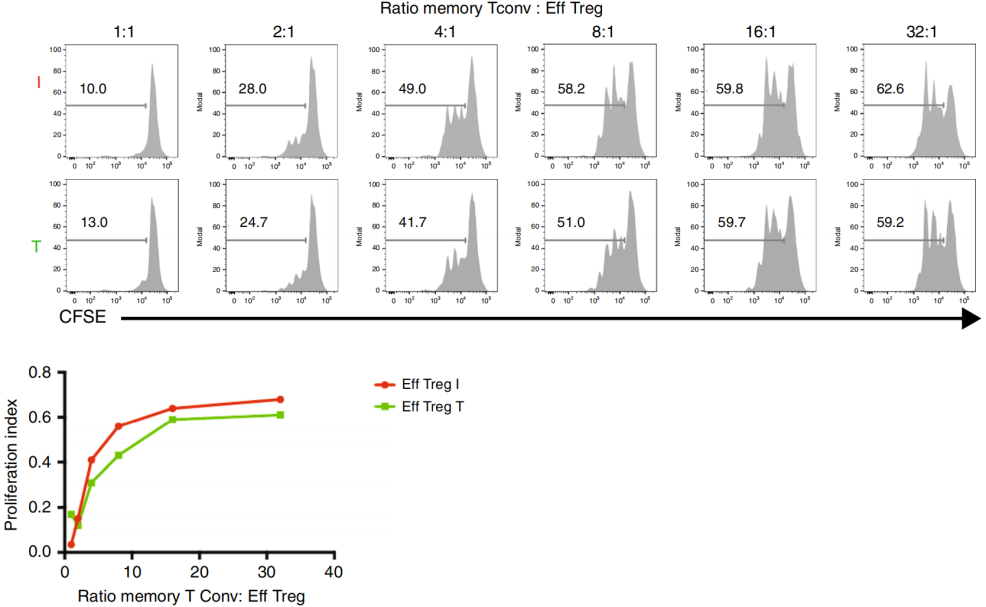
这些结果说明Treg在TDLN和肿瘤组织中行使免疫抑制功能。接下来作者根据不同的marker基因将Treg分为多种亚型,并且发现Tr1和Tfr亚型比例较高,这里不再展开。
4. 存在TDLN和肿瘤组织共享TCR的Treg
为了进一步分析CD4+ T细胞亚群,作者对分选的T细胞进行TCR-seq。结果显示Treg在三种类型组织中克隆扩增程度均高于Tconv,如下图;并且Treg和Tconv的TCR库在肿瘤中的多样性低于TDLN,这表明肿瘤中存在肿瘤特异性CD4+ T细胞的积累。
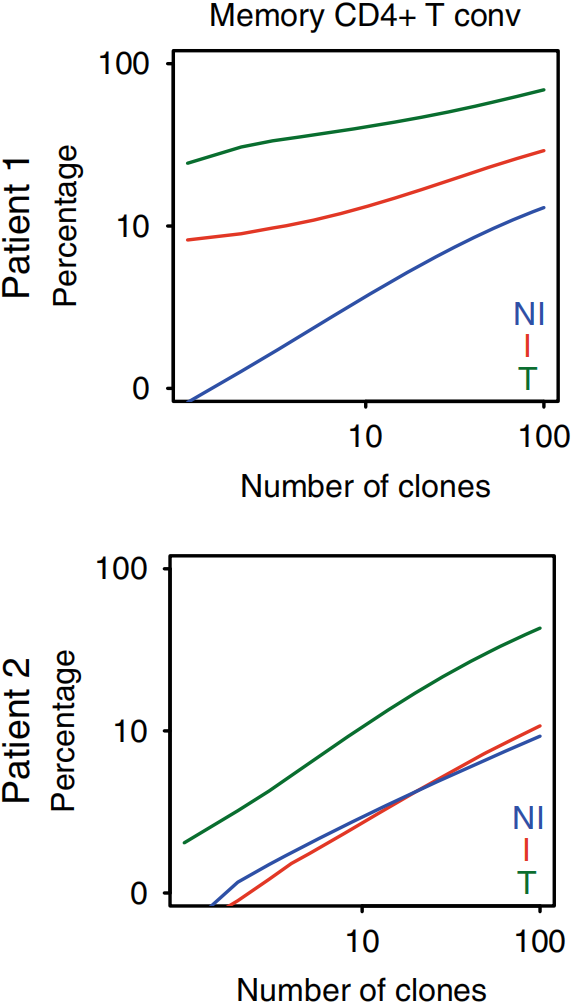
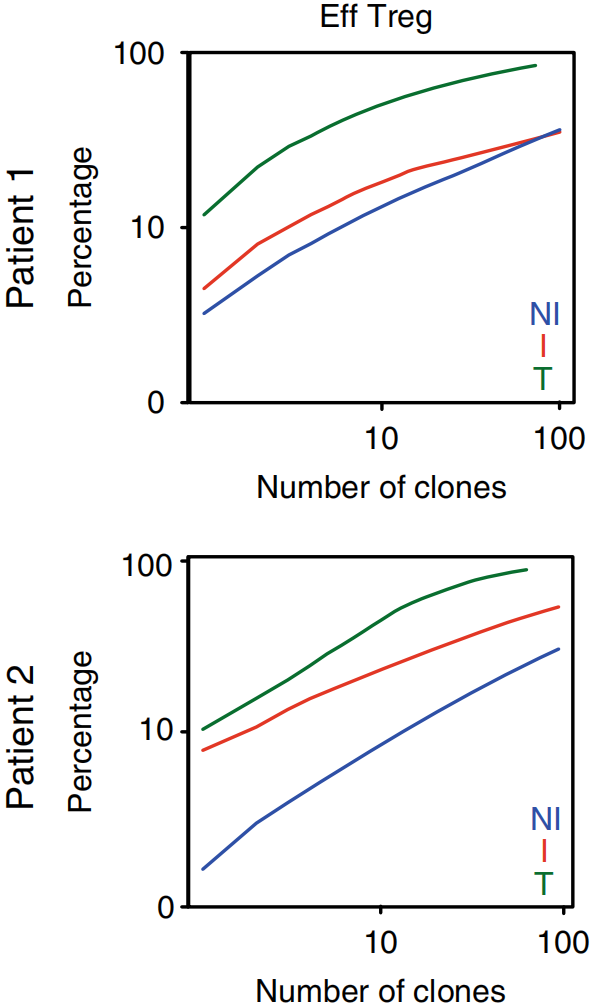
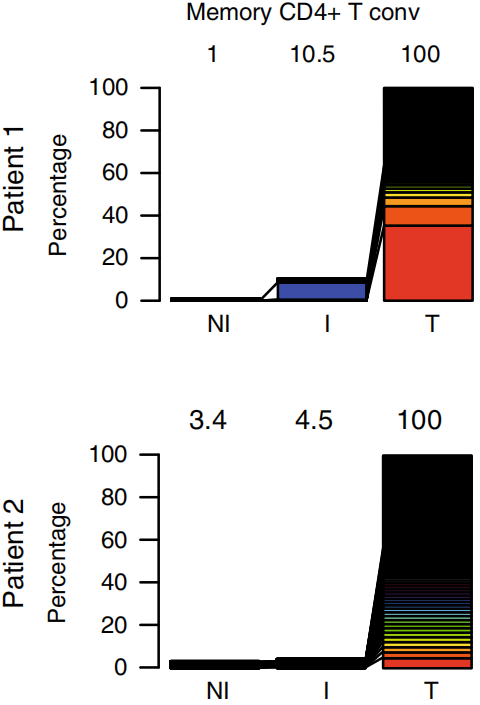
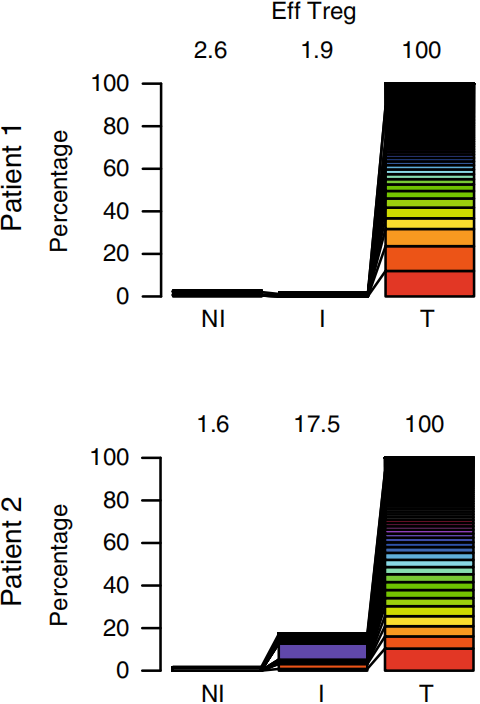
将三种组织类型Top100 TCR克隆型取交集,结果显示对于Tconv,两个病人肿瘤组织中分别有10.5%和4.5%的Top100 TCR克隆可以在I TDLN中发现,1%和3.4%可以在NI TDLN中发现,如下图左。对于Treg,1.9%和17.5%的Top100 TCR克隆可以在I TDLN中发现以及2.6%和1.6%可以在NI TDLN中发现,如下图右。这些结果表明肿瘤特异性Tconv和Treg克隆在肿瘤和TDLN之间再循环。
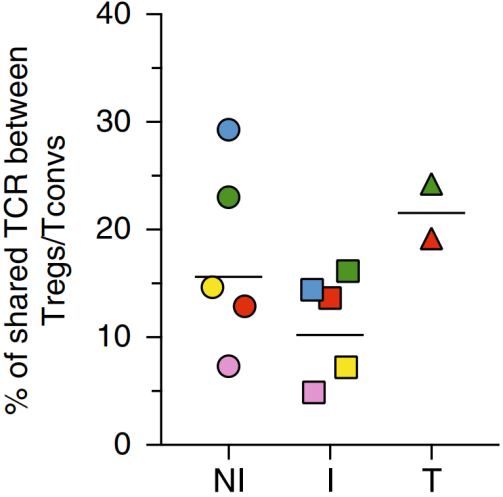
肿瘤特异性的Treg可以从胸腺中产生(tTreg),也可以从外周血中的Tconv转换而产生(pTreg)。为了确认pTreg的存在,作者将Treg和Tconv的TCR克隆取交集,结果显示三种组织类型中均存在共享的TCR克隆,如下图。
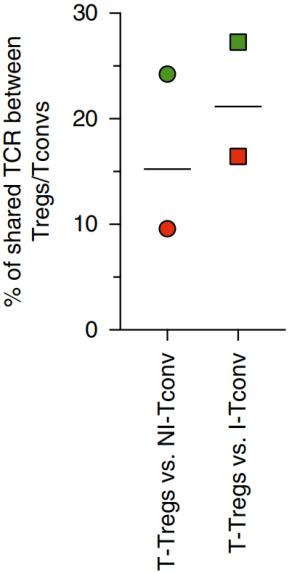
此外,分别在NI和I TDLN中存在的Tconvs中也发现了16.9%和21.9%的肿瘤特异性Treg克隆型,如下图,说明肿瘤特异的Treg克隆型与Tconvs以组织间方式共享。
5. I TDLN中的Treg显示出独特的转录组表达模式
将三种组织类型分选的Treg和Tconv分别进行Bulk RNA-seq,结果如下图。
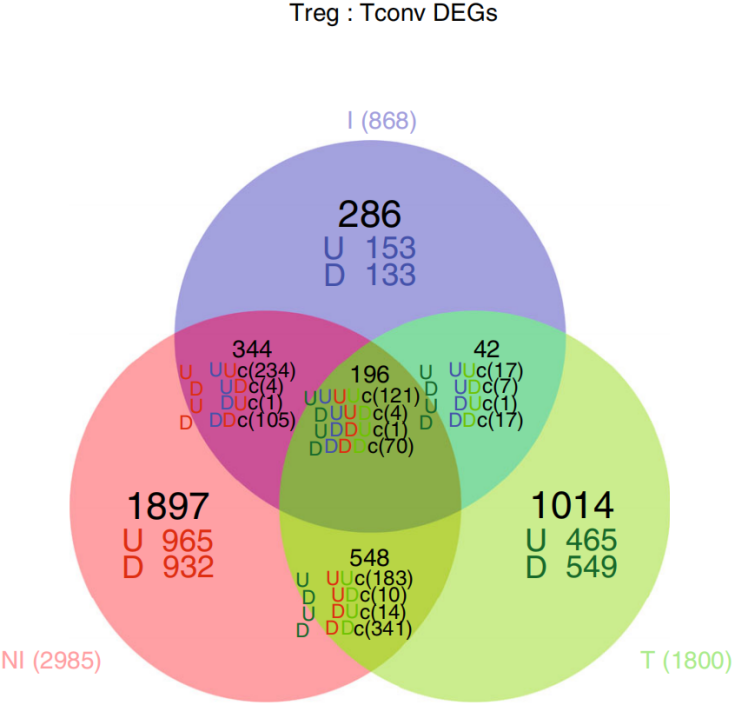
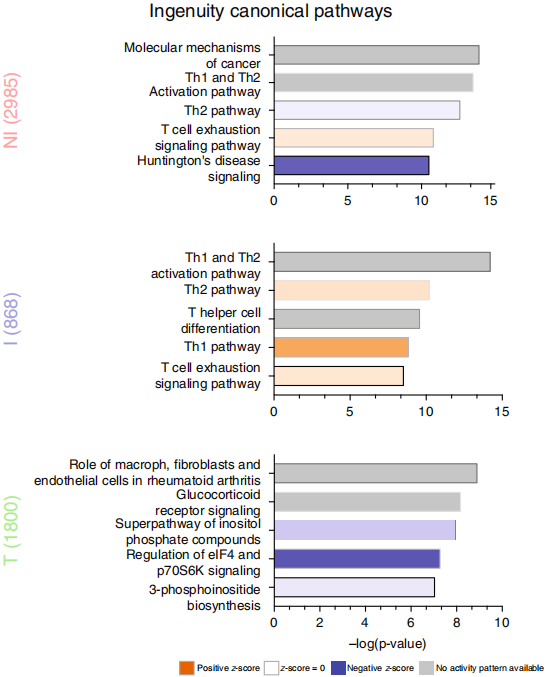
将差异基因进行GO/KEGG富集分析可以发现可以富集到一些经典通路,如下图。
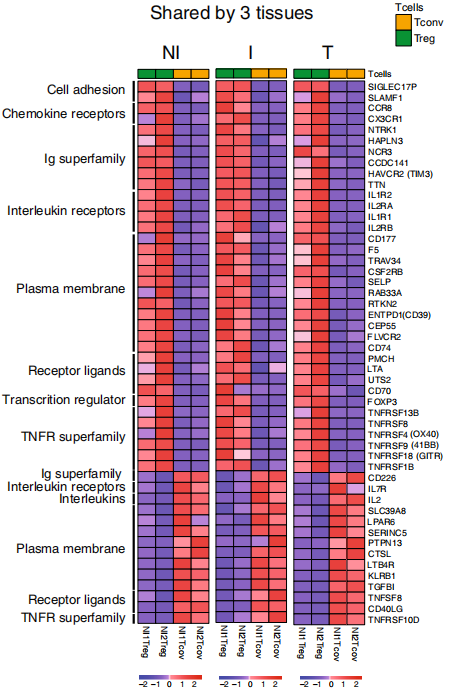
将差异基因进一步划分,Treg和Tconv在三个组织类型中均上调表达的基因(UUU)作为共同特征,包括FOXP3、IL2RA等,而且富集到调节T细胞、IL-2信号等通路,如下图。Tconv独有的特征基因(DDD)包括IL7R、CD40LG等,如下图,富集到CD4+ T细胞核FAS等通路。
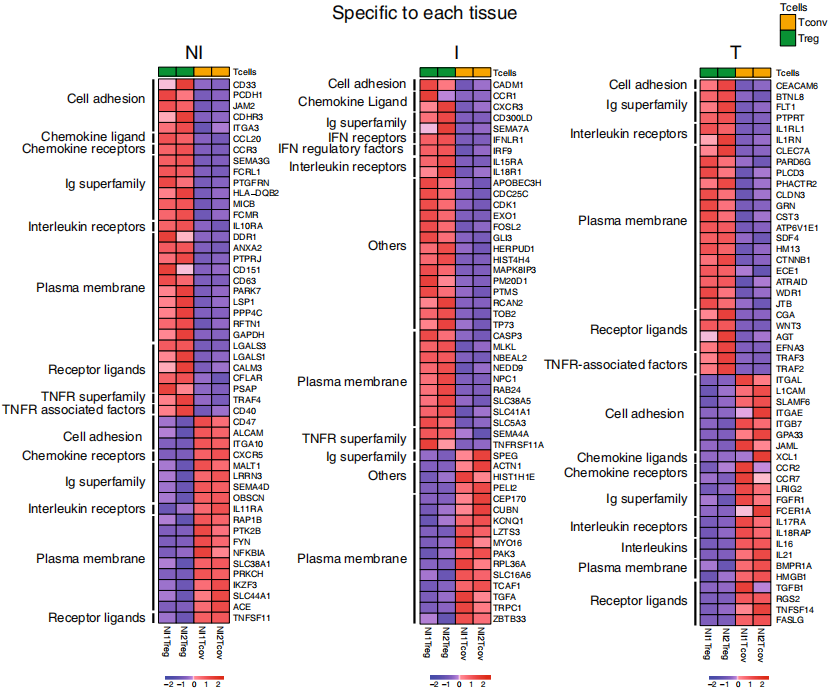
作者接下来通过对T细胞迁移、功能或靶标选择潜力的影响来挑选Tconv和Treg细胞的特征标志物,并展示其表达水平。
6. 表达CD80的肿瘤特异性Treg与不良预后有关
为了评估在TDLN和肿瘤的Treg中高表达的差异基因的临床相关性,作者使用TCGA数据库建立关联。首先评估的是FOXP3,但是FOXP3表达水平与病人的生存率没有显著关联,于是作者转向与FOXP3表达水平相关的基因,获得了10个候选基因,其中三个基因与不良生存率有关,如下图。
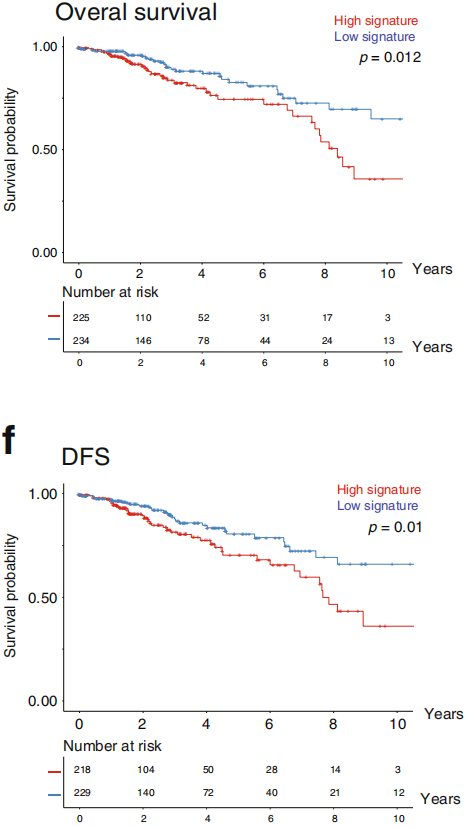
进一步分析发现只有CD80与FOXP3表达水平同时升高与不良生存率显著相关,如下图。
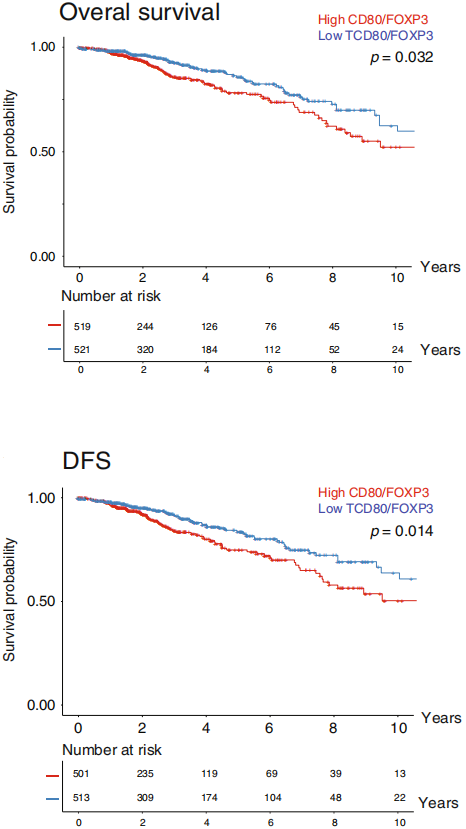
随后作者使用FACS确认肿瘤特异的Treg高水平表达CD80,如下图。
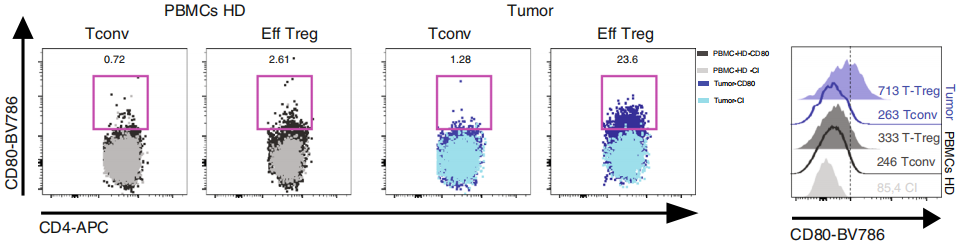
而且肿瘤特异性Treg的CD80荧光值大于Tconv和健康人外周血Treg,如下图,说明表达CD80的Treg可以定义与不良预后相关的高度活化/抑制性Treg的亚群,可以作为潜在治疗靶点。

#
总结
作者以乳腺癌患者的原发位、肿瘤浸润与否的淋巴结为材料入手,系统追踪T细胞的组成、来源和功能,为乳腺癌治疗提供了潜在靶点:
1. 通过FACS在三个不同组织中分选不同类型的细胞,并将T细胞分类;
2. 确认T细胞类型后,发现各组织T细胞表达的免疫检查点分子不同;
3. 抑制试验发现Treg细胞行使免疫抑制功能;
4. TCR-seq发现肿瘤特异性Treg在三种类型组织中循环,并且提供外周血Tconv诱导形成Treg的证据;
5. RNA-seq确定三个部位的Treg和Tconv表达模式不同,并差异基因富集的通路筛选各细胞的特征基因;
6. 最后通过数据库分析发现高表达CD80的Treg亚群与不良预后有关,可以作为潜在治疗靶点。
#
参考文献
Núñez, N.G., Tosello Boari, J., Ramos, R.N. et al. Tumor invasion in draining lymph nodes is associated with Treg accumulation in breast cancer patients. Nat Commun 11, 3272 (2020). DOI:10.1038/s41467-020-17046-2
#
延伸阅读











