20230113 康测科技UID RNA-seq助力中山大学眼科中心唐家辉博士发表Antioxidants

#
引言
青光眼是老年人视力障碍的一大元凶,视网膜神经节细胞累计损伤是引起青光眼的一大特征。本期带来康测科技中山大学眼科中心客户的文章,详细阐述游离锌离子增加会导致视网膜神经节细胞的损伤,客户是如何发现其中机制的,让我们一起看看吧。
#
背景
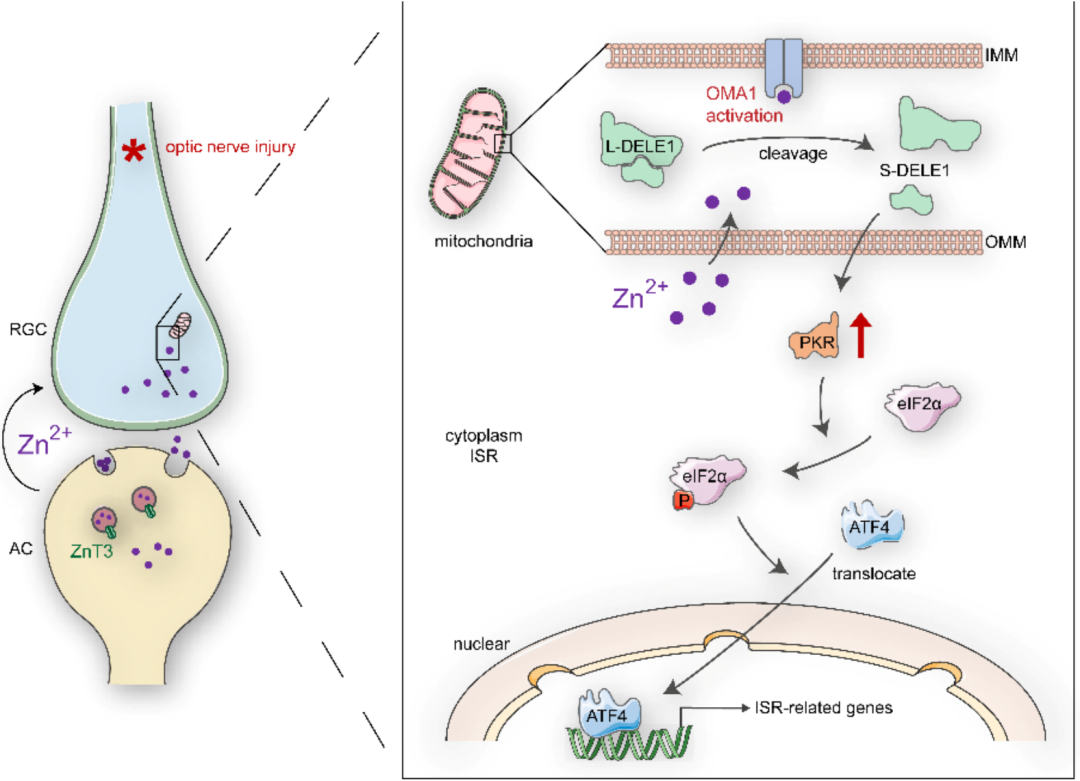
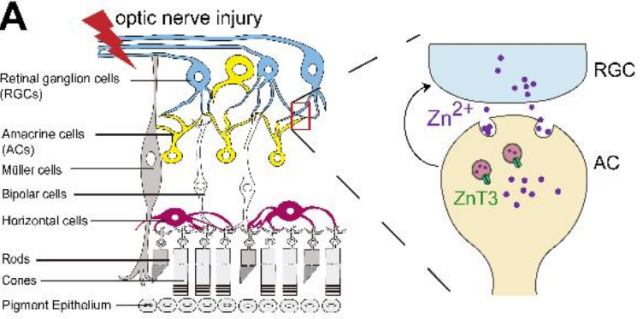
视网膜神经节细胞(RGC)累积性损伤是青光眼的一个重要标志。促进RGC存活是视网膜-脑连接再生和视功能恢复的潜在前提。从机制上看,视神经损伤后1小时内,突触前中间神经元无长突细胞(AC)释放的流动锌(Zn2+)增加,然后通过突触囊泡转移到突触后投射神经元RGC,导致RGC损伤(图1A)。然而,Zn2+在突触后RGC体细胞损伤的下游机制尚不清楚。本研究发现Zn2+水平的升高会使视网膜线粒体锌金属肽酶OMA1的表达和活性上调,进而导致细胞死亡增强子1 (DELE1)的裂解和细胞质eIF2α激酶PKR的激活,并触发RGCs的综合应激反应(ISR)。下面让小编带大家回顾下本文的研究思路吧!
#
研究思路
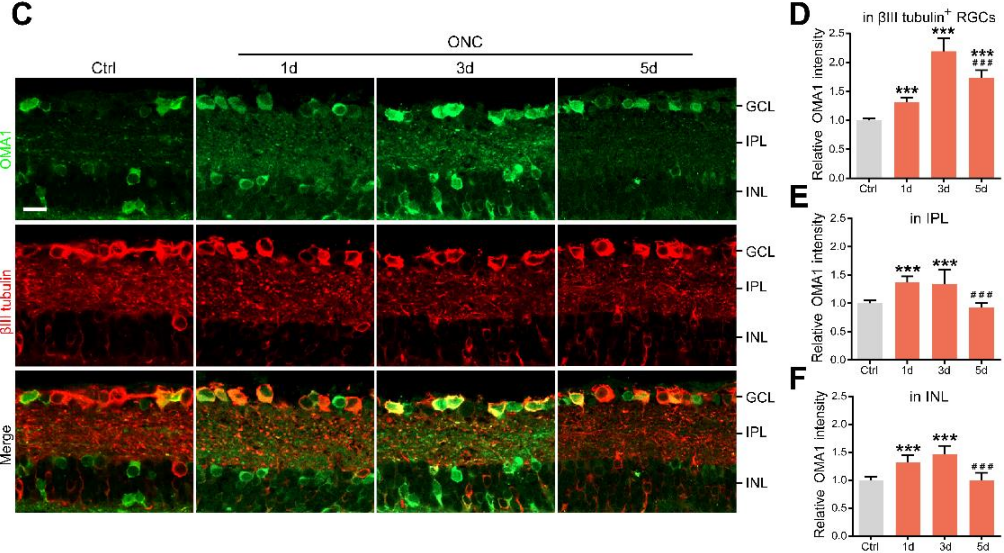
1. 视神经损伤后视网膜内OMA1表达上调
由于Zn2+和线粒体功能障碍均可导致视神经损伤后累积性RGC损失,而线粒体锌金属蛋白酶OMA1能感知线粒体应激并调节其稳态。在此基础上,作者首先评估了OMA1的表达水平来研究其与视神经损伤的关系。通过免疫染色和qPCR显示在正常视网膜组织中只检测到中等水平的OMA1,而内核层(INL)、内丛层(IPL)和神经节细胞层(GCL)的OMA1水平在视神经挤压(ONC)处理1天后显著升高,并持续升高至第3天(下图C-F)。
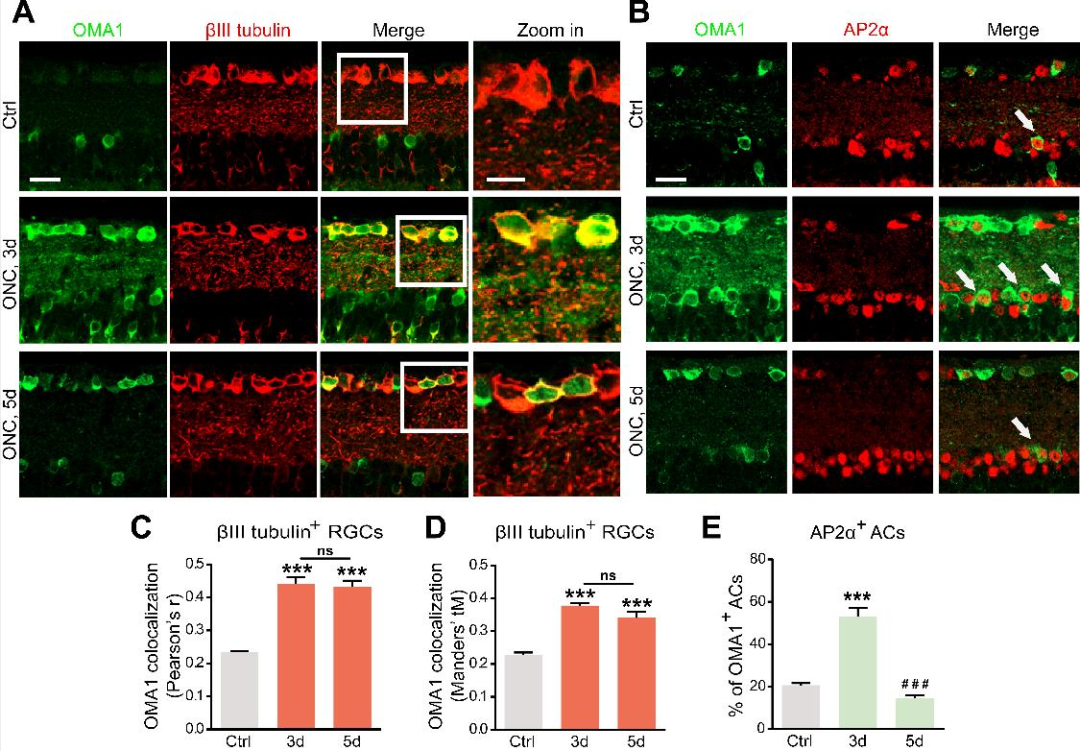
2. OMA1的视网膜细胞定位
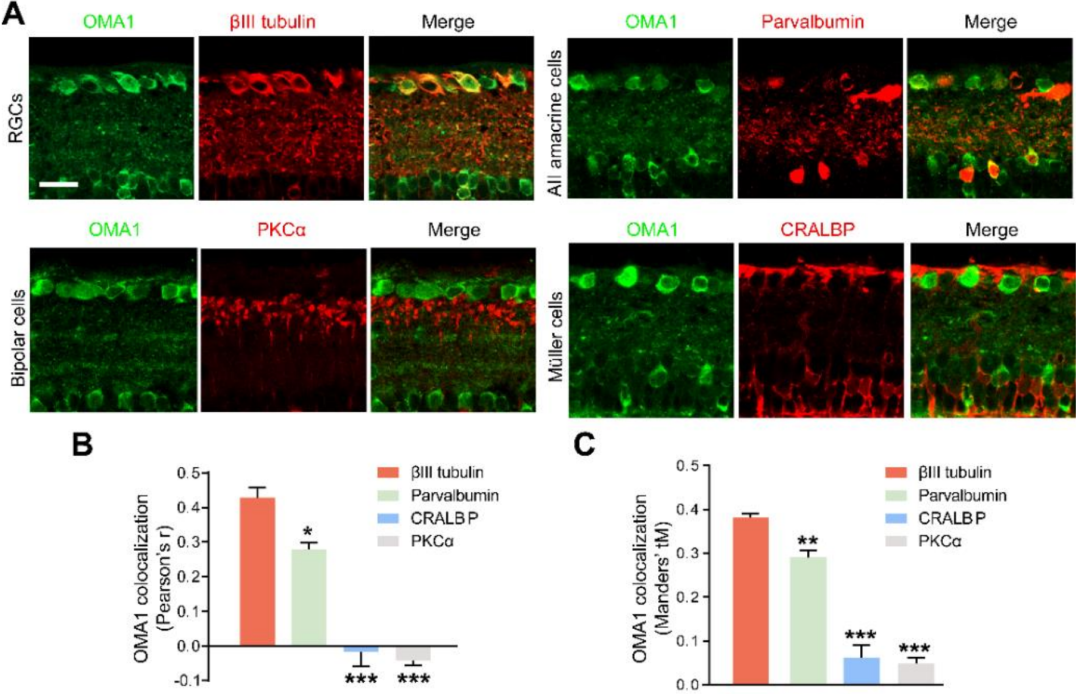
由于视网膜内的OMA1表达趋势与AC和RGC中Zn2+的跨突触过程平行,促使作者分析OMA1在视网膜内部的共定位和细胞类型特异性。双免疫荧光染色显示正常视网膜中有微弱重叠,而在ONC模型中,第3天和第5天OMA1和RGC marker基因βIII微管蛋白之间有大量重叠(下图A、C、D)。使用泛无长突神经细胞marker基因AP2α来观察INL中AC的细胞核,细胞核中AP2α阳性和细胞质OMA1阳性的细胞被定义为OMA1+ AC。结果发现,OMA1+ AC的百分比从正常视网膜中的20.60±1.01%增加到ONC视网膜中的53.19±3.82%,然后在第5天下降到14.40±1.59%(下图B、E)。数据证实AC细胞的OMA1表达水平在第3天达到峰值后明显下降,而OMA1在RGC中的表达水平仍然较高。
此外,作者检测到OMA1与小清蛋白(parvalbumin)有明显的共定位,parvalbumin是AII无长突神经细胞的marker基因,是AC的一个独特亚型(下图A)。然而,OMA1很少与Müller细胞的marker基因CRALBP或双极细胞突触marker基因PKCα发生共定位(下图A-C),表明OMA1主要分布在AC和RGC中,而不在其他视网膜中间神经元和胶质细胞中,暗示OMA1在AC-RGC调控网络中可能起关键作用。
3. Zn2+介导OMA1上调和线粒体损伤
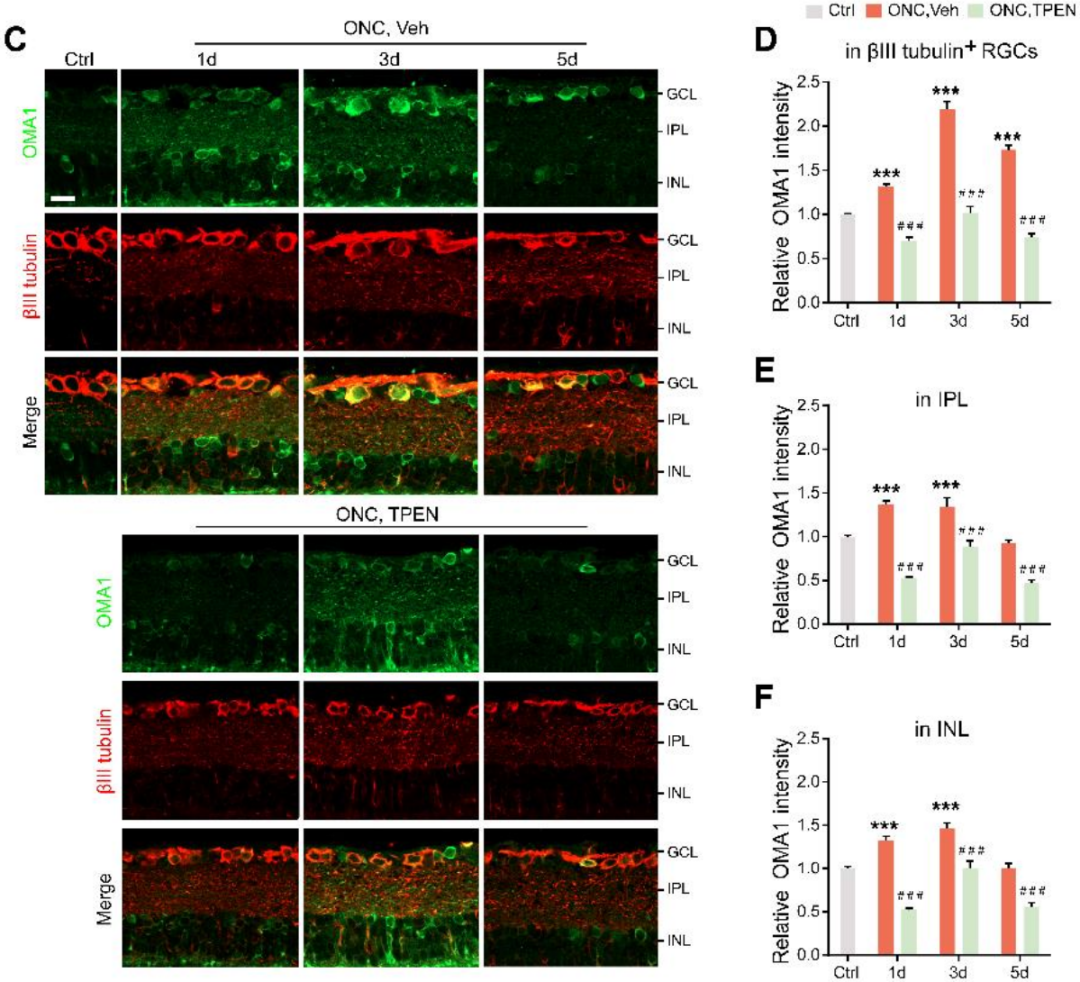
为了进一步研究OMA1的水平是否受到Zn2+调控,并评估药理学上抑制Zn2+对视网膜线粒体的影响,作者在ONC处理后立即向眼内注射Zn2+螯合物TPEN,结果表明TPEN在第1天、3天和5天将OMA1的表达水平降低到接近或低于基线水平(下图C-F)。进一步观察发现TPEN诱导的OMA1下调在INL和IPL中相似,在GCL内βIII微管蛋白阳性的RGC中更为显著,这与TPEN在视网膜中的通透性和Zn2+消除作用一致(下图C-F)。此外,注射TPEN后,OMA1免疫荧光染色结果显示其仍在第3天达到峰值,第1天和第5天水平相对较低,说明TPEN诱导的OMA1下调是通过螯合Zn2+介导的。
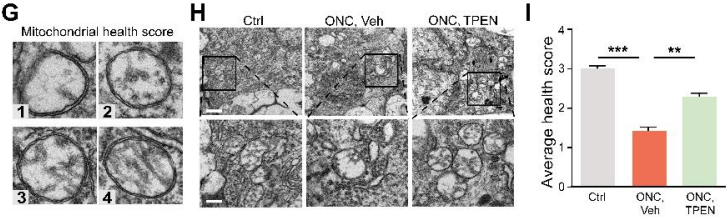
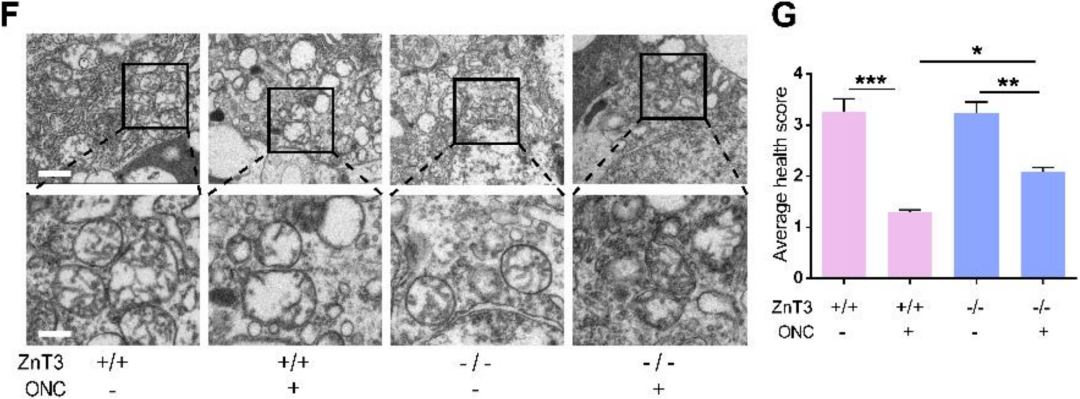
为了确定视神经损伤时Zn2+与RGC线粒体损伤的关系,研究者使用透射电镜对RGC线粒体进行了检测,依据嵴外观对线粒体健康打分(图4G)。发现ONC处理7天后照片显示线粒体严重肿胀,基质密度降低,嵴破裂,RGC线粒体内外膜完整性消失(图4H)。与对照组相比,TPEN处理组具有更高的线粒体健康评分(图4H,I)。这些结果表明,Zn2+螯合可以缓解ONC诱导的线粒体损伤。
总的来说,视神经损伤后,Zn2+上调视网膜内OMA1,介导RGC线粒体损伤。早期Zn2+螯合抑制OMA1,保护RGC线粒体,提示这是TPEN保护RGC的长期机制。
4. 阻断Zn2+跨突触转运能降低OMA1表达并减轻线粒体结构损伤
作者前期研究已证明Zn2+是由ZnT-3转运到AC突触囊泡中,导致Zn2+在GCL细胞中积累。因此作者构建ZnT-3缺失小鼠模型(ZnT-3-/-),其可以部分减少RGC中Zn2+的积累。
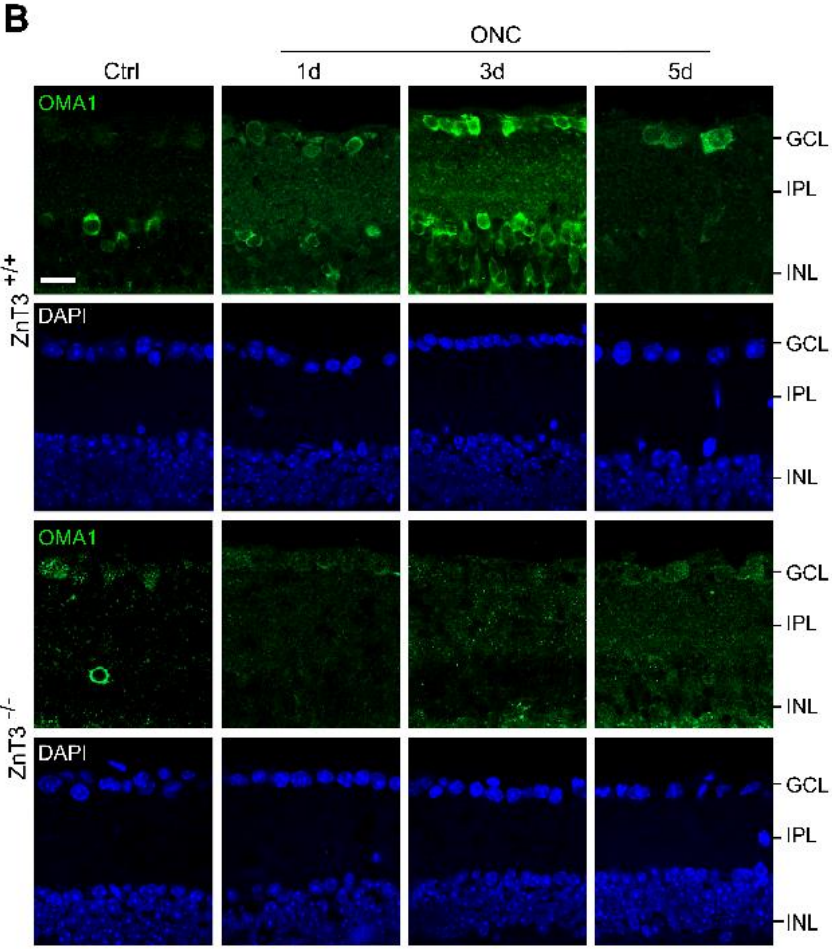
免疫荧光染色显示,在AC中缺失ZnT-3不影响对照组小鼠中OMA1的表达水平,但在ONC处理后第1天和第3天,INL、IPL和GCL中OMA1的表达水平显著降低。而ONC 处理5天后ZnT-3-/-小鼠视网膜中的OMA1表达水平与野生型INL和IPL相比没有显著差异,但对GCL具有持续的抑制作用(下图B-E)。此外,与TPEN注射后不同,OMA1在ZnT-3-/-小鼠中的表达水平并没有在第3天达到峰值,而是在ONC处理后0-5天内持续升高。这些结果表明,通过阻断Zn2+的突触转运可以部分消除RGC中Zn2+的积累,从而降低OMA1的早期表达水平。
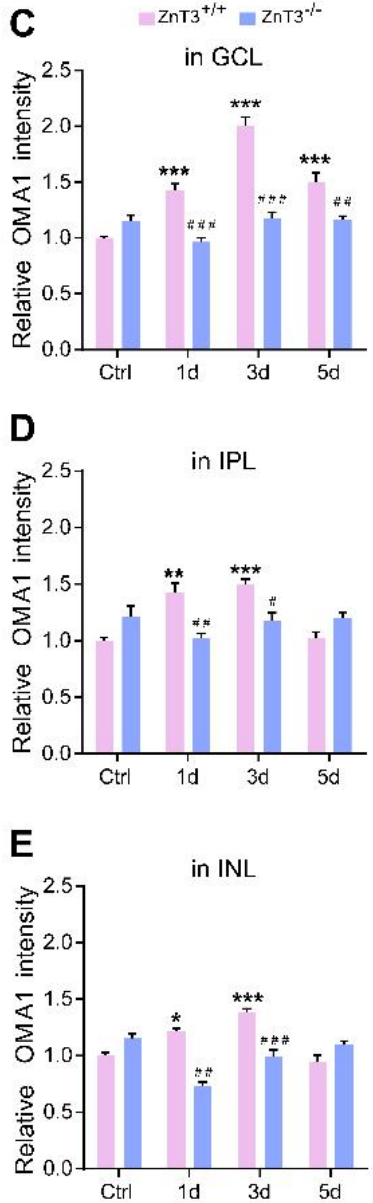
在ONC处理7天后,ZnT-3-/-小鼠RGC中线粒体健康程度高于对照组(下图F、G),因此,Zn2+的螯合和转运阻断抑制了视网膜内部的OMA1表达水平,并保护了RGC细胞的线粒体,这表明OMA1的过度表达和线粒体损伤是由Zn2+介导的。
5. Zn2+增加DELE1的切割
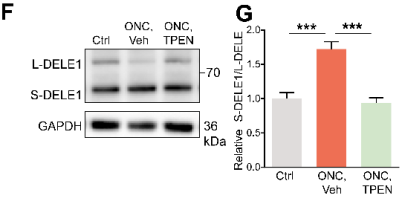
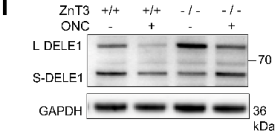
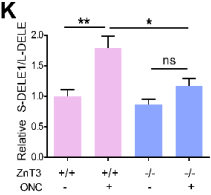
在线粒体处于应激状态时,OMA1可以将长(L-) DELE1切割为短(S-) DELE1,OMA1-DELE1信号将线粒体应激与细胞质ISR联系起来在不同类型细胞中是一种保守机制。作者对视网膜DELE1蛋白进行WB定量,结果显示ONC处理后3天, S- DELE1/L- DELE1的比值显著升高,注射TPEN可使S-DELE1/L-DELE1比值降低至基线水平(下图F、G)。与上述结果一致,敲除ZnT-3能部分恢复DELE1的切割(下图I、K)。这些结果表明,ONC处理诱导的Zn2+刺激DELE1的切割。
6. Zn2+-OMA1-DELE1轴对RGC综合应激响应(ISR)的影响
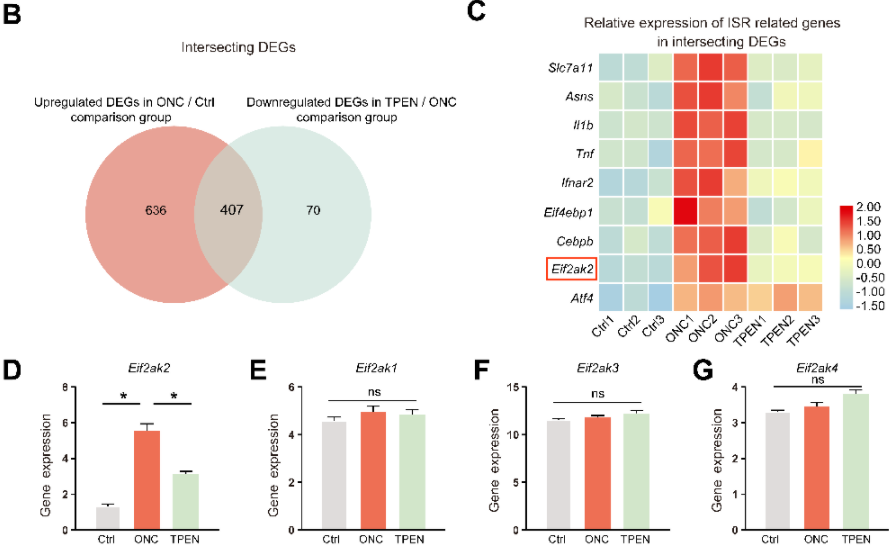
为了确定ISR是否是DELE1切割的下游信号通路,研究者在ONC处理3天后分离RGC进行了UID RNA-seq,并重点关注ONC处理后上调表达的差异基因以及TPEN处理后恢复的基因(下图B)。结果证实线粒体ISR相关基因,如ISR诱导的炎症介质(Il1b和Tnf)、eif2α-磷酸化因子(Eif2ak2)和ATF4靶标(Slc7a11、Asns和Cebpb)在差异表达基因中出现(图7C)。值得注意的是,eIF2α的磷酸化是由Eif2ak1-4编码的四个eIF2α激酶(HRI, PKR, PERK和GCN2)介导的。UID RNA-seq结果表明ONC和TPEN处理不影响Eif2ak1、3和4的活性,这说明TPEN处理是通过特异性下调Eif2ak2表达水平来抑制eIF2α的磷酸化和ISR的激活(下图D-G)。
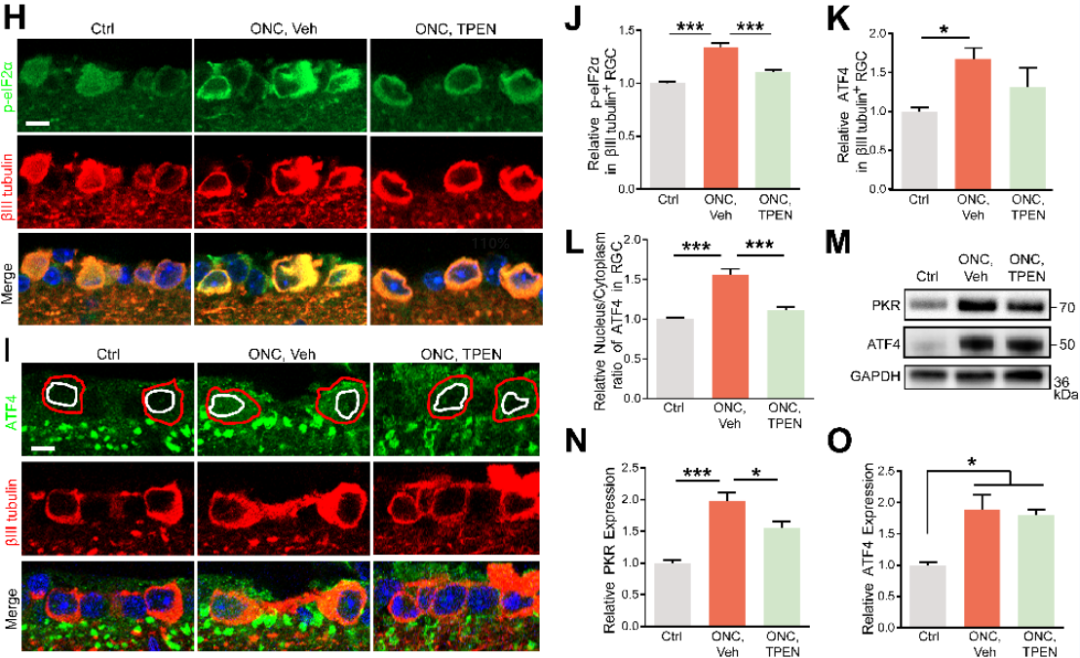
同时,作者还检测了PKR(由Eif2ak2编码)、磷酸化eIF2α (p-eif2α)和ATF4的蛋白水平,结果显示与正常视网膜相比,在第5天观察到ONC视网膜中PKR和p- eIF2α蛋白水平的升高,而TPEN处理可以恢复PKR和p-eIF2α的蛋白水平(下图H、J、M、N)。通过RNA-seq、免疫荧光染色和WB,作者注意到TPEN组RGC中ATF4的转录和蛋白水平与对照组相比没有变化(上图C,下图I,K,M,O)。ISR激活后,ATF4通过细胞质-核易位进行翻译重编程,因此通过进一步分析ATF4在RGC中的亚细胞定位可以发现ATF4的核/质比在ONC处理后5天升高,而经TPEN处理后降低(下图I、L)。这些结果证实是Zn2+诱导OMA1转录激活和S-DELE1积累进而导致RGC中的ISR可能是通过上调PKR表达水平完成的,而TPEN处理显著抑制了PKR的表达。
7. Zn2+-OMA1和ISR在同一信号通路中调控RGC存活
那么Zn2+-OMA1-PKR-ISR通路是否参与ONC处理后RGC细胞死亡过程呢?通过ONC处理后立刻眼内注射TPEN,与对照组相比可显著提高14天后RGC生存率(下图A、C)。此外,作者还研究了ZnT-3的条件敲除对RGC存活的影响。与小鼠模型相似,AC中ZnT-3条件敲除能促进视神经损伤后RGC的存活(图8B,D)。
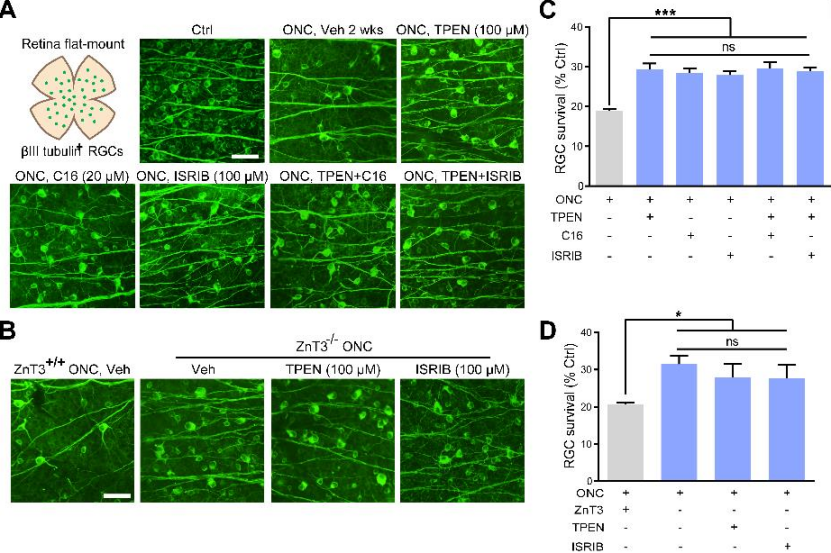
这些结果说明Zn2+-OMA1和PKR诱导的ISR是视神经损伤发病机制中造成RGC损失的主要中介。
#
总结
这篇文章阐明视神经损伤中的RGC损失需要增加突触Zn2+转运,从而激活OMA1表达,引起DELE1切割和PKR表达水平升高,最后导致突触线粒体嵴破坏和ISR,其中康测科技UID RNA-seq帮助作者确定ISR是DELE1切割的下游事件,我们总结下
作者的工作:
1. 视神经损伤中RGC细胞中OMA1表达水平升高;
2. 使用Zn2+螯合剂TPEN处理后发现RGC中OMA1表达水平升高与Zn2+有关,并且Zn2+还与线粒体损伤和DELE1切割有关;
3. 构建Zn2+转运蛋白ZnT-3缺失小鼠模型,证明阻断Zn2+转运可以降低OMA1表达水平、缓解RGC的线粒体损伤;
4. UID RNA-seq确定DELE1切割下游事件是ISR,阻断Zn2+转运可以缓解ISR并提高RGC细胞的存活率。
#
参考文献
Tang, J.; Liu, Z.; Han, J.; Xue, J.; Liu, L.; Lin, J.; Wu, C.; Zhang, Q.; Wu, S.; Liu, C.; et al. Increased Mobile Zinc Regulates Retinal Ganglion Cell Survival via Activating Mitochondrial OMA1 and Integrated Stress Response. Antioxidants 2022, 11, 2001. DOI: 10.3390/antiox11102001.
#
延伸阅读