20230106了解了这篇文献内容,肿瘤君,你再想逃就难啦!!

#
引言
组蛋白修饰与细胞内代谢产物息息相关,前面文献解读我们介绍了乙酰CoA可以影响组蛋白乙酰化修饰,而乳酸堆积可以影响组蛋白乳酸化修饰。鉴于目前组蛋白乳酸化修饰的热度,这次带来一篇由肿瘤代谢产生的乳酸堆积诱导H3K18la修饰水平升高,最后影响METTL3表达水平并产生一系列影响,让我们一起来看看吧。
#
背景
肿瘤浸润T淋巴细胞(TIL)的功能失调或耗竭状态可以导致肿瘤的免疫逃逸和进一步进展。然而,肿瘤微环境(TME)是一个复杂的生态系统,其中包含同时具有促肿瘤和抗肿瘤作用的获得性(T/B细胞)和先天性免疫细胞(髓系免疫细胞),这显着影响免疫治疗的结果。髓系细胞在大多数类型的肿瘤中均含量丰富,可以通过分泌调节细胞因子、表达免疫检查点分子和改变免疫代谢来抑制T细胞功能的优势群体。这些促进肿瘤发展的髓系细胞主要有肿瘤相关的巨噬细胞(TAM)、肿瘤相关的中性粒细胞(TAN)、髓系抑制细胞(MDSC)和调节树突细胞(DCreg)。TM中的成分(包括趋化因子、促炎细胞因子、生长因子和代谢调节因子)可以影响肿瘤浸润髓系细胞(TIM)的分化和功能。在获得骨髓细胞的免疫抑制特征期间,JAK-STAT和NF-kB通路作为关键调节因子。
康测科技多篇文献解读已经介绍了m6A的原理和研究套路,主要关注的就是m6A相关蛋白:Writer、Reader和Eraser,这里不再过多介绍。那么TIM免疫抑制功能是通过何种机制,又是如何与m6A和组蛋白乳酸化产生关联的呢?让我们来看正文部分。
#
研究结果
1. TIM中METTL3的表达水平增加
作者首先分析TGCA数据库中RNA-seq数据后发现METTL3 在多种类型的肿瘤组织中表达上调(下图A),并且其表达与免疫评分呈负相关(下图B);在结肠癌组织中METTL3 的表达与T细胞耗竭标志基因的表达呈正相关,与髓系相关基因的表达也呈正相关(下图C)。
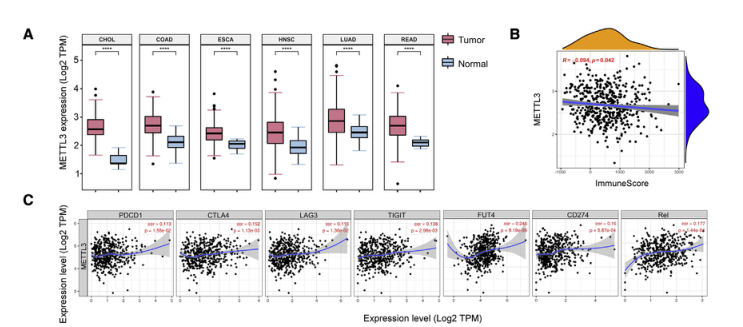
为了进一步确认METTL3在TIM中的作用,荧光抗体染色结果显示TIM中METTL3的平均荧光强度(MFI)比配对的正常邻近组织中的对照细胞显著升高(如图D、E)。

这些结果说明METTL3可能会促进免疫耗竭,因此下一步应该验证TIM中METTL3表达水平对免疫抑制的影响。
2. 肿瘤衍生因子诱导TIM中METTL3表达增加
根据qRT-PCR和WB检测结果发现当小鼠骨髓来源的巨噬细胞(BM-MΦ)与与一些肿瘤共培养时,METTL3表达量显著增加(图A-C);

使用流式细胞术分离肿瘤小鼠模型的MDSC细胞与健康小鼠来源细胞比较,qPCR结果发现肿瘤小鼠来源的MDSC细胞中METTL3表达水平更高(如图D)。流式检测CD45+CD11b+F4/80+Mɸ和CD45+CD11b+Gr-1+MDSC中METTL3表达水平,与无肿瘤小鼠相比METTL3表达水平上调(如图E、F)。
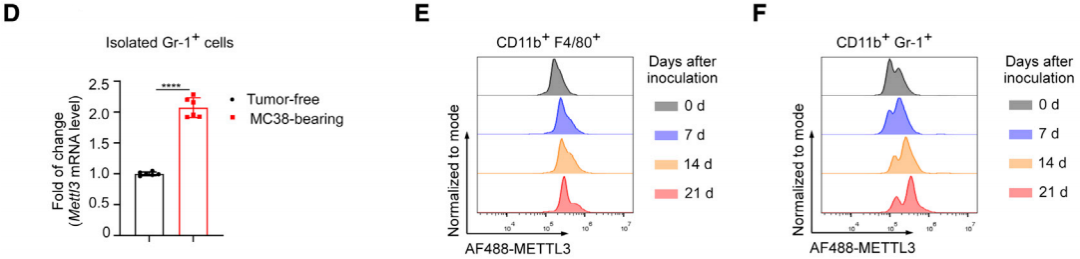
3. METTL3缺失会使TIM转变为抑制肿瘤发展
在确认m6A相关蛋白表达量发生变化后,第一反应是将METTL3敲低观察是否会有表型上的变化,于是作者构建了METTL3基因敲除小鼠模型(cKO),同时向WT和cKO小鼠皮下接种MC38结肠癌细胞,结果表明髓系细胞中METTL3的缺失显著减少了肿瘤的生长(如图G-I)。

STM2457是METTL3催化抑制剂,使用STM2457处理BM-MФ和MDSC细胞36h,然后将它们与MC38细胞(1: 2)混合接种。结果显示STM2457治疗减缓了MC38肿瘤的生长(图2L和2M)。因此,METTL3可能具有针对TIM的免疫治疗的潜力,然而,使用METTL3抑制剂进行体内治疗是否能有效地抑制小鼠肿瘤的进展仍需进一步研究。

4. METTL3缺失缓解TME的免疫抑制作用
为了确定METTL3的髓系缺陷是否重塑了肿瘤免疫微环境,作者检测了TIL的频率,与携带MC38的WT小鼠相比,cKO小鼠的CD4T+和CD8+T细胞群没有差异(如图A)。

PD-1和Tim-3是促进T细胞耐受的关键免疫检查点,携带MC38的cKO小鼠PD-1+Tim-3+耗竭CD8+T细胞的浸润减少(如图B、C),而cKO小鼠的CD4+CD25+ 调节T细胞(Treg)减少(图D)。


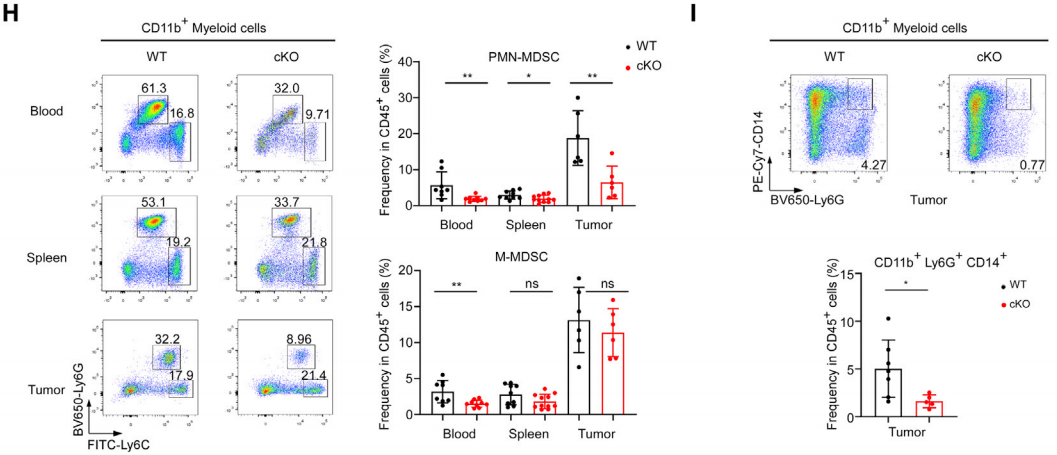
在髓系方面,cKO小鼠CD45+CD11b+髓系细胞数量减少。METTL3在髓系细胞中的缺失导致CD206+M2样TAM的浸润率降低,而具有强大抗原呈递能力的CD103+ cDC1的浸润率增加(如图G)。缺失METTL3阻止(PMN)-MDSC在外周血、脾和肿瘤部位的聚集,并减少了M-MDSC在外周血中的渗透(图H)。CD14+Ly6G+ PMN-MDSC在cKO小鼠肿瘤组织中的渗透较少,这些细胞被新定义为区别于TAN的关键免疫抑制细胞群(图I)。这些结果共同验证了髓系METTL3有效地驱动TIM在肿瘤部位的免疫抑制作用。

5. METTL3-m6A修饰靶向Jak1增强JAK-STAT3信号转导过程
缺失METTL3的MDSC的功能会有什么变化呢?作者进行了T细胞抑制实验。T细胞与cKO小鼠的MDSC共培养,经anti-CD3和anti-CD28刺激后,T细胞增殖受到的抑制较小,并产生较多的干扰素(如图A、B)。
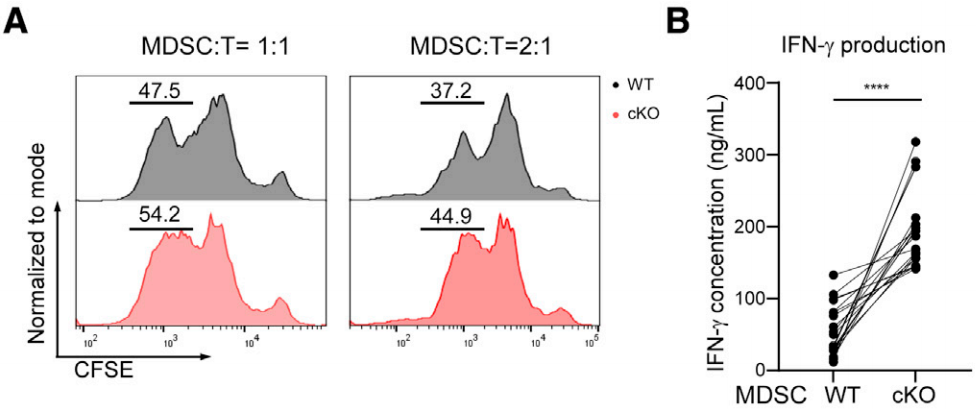
为了探讨METTL3介导的促肿瘤作用的机制,对WT和cKO的BM-Mɸ进行RNA-seq,结果表明一些促肿瘤基因和免疫抑制基因在cKO BM-Mɸ中表达下调(如图C)。此外,KEGG信号通路分析表明,髓系细胞中METTL3的缺失影响了JAK-STAT信号通路;GO分析表明,METTL3的缺失主要影响先天免疫反应和炎症相关基因(如图D、E).


许多研究已经确定STAT3信号是TAM功能的关键调节因子。因此,为进一步了解METTL3介导的m6A修饰对JAK-STAT3通路的影响,作者先对实验样本中JAK1和STAT3蛋白水平进行检测,实验结果表明与WT小鼠细胞相比,cKO BM-Mɸ或MDSC的JAK1和STAT3磷酸化水平均减少,而对总STAT3或JAK2蛋白水平没有影响(如图F、G)。利用FCM与qRT-PCR对BM-Mɸ或MDSC中JAK-STAT3通路下游的促肿瘤分子的变化进行研究(如图J-M),髓系细胞来源的一氧化氮(NO)和活性氧(ROS)是T细胞抑制的关键免疫抑制效应因子,根据FCM结果显示缺失METTL3的TAM以及MDSC产生的ROS和NO水平明显降低(如图L-I)。

6. METTL3-m6A-YTHDF1促进多聚核糖体中JAK1 mRNA的翻译过程
作者进一步探索METTL3-m6A修饰对JAK1转录本的影响。首先进行meRIP-seq,确认Jak1转录本上存在m6A修饰(下图A),而且具有RRACH的motif。
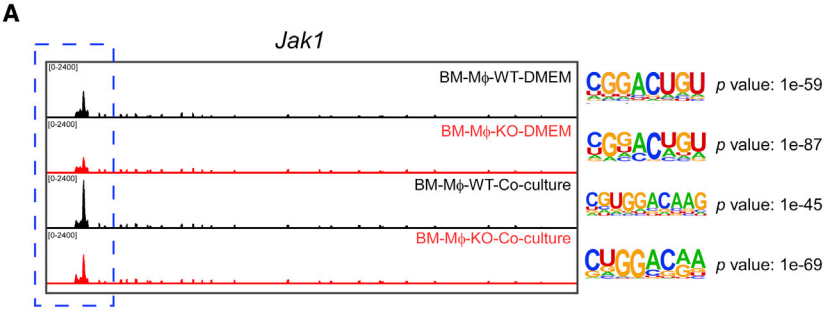
为了阐明METTL3介导的m6A修饰在JAK1 mRNA代谢中的作用,通过qPCR结果说明METTL3不影响JAK1的转录水平(如图B)。当细胞经蛋白酶体抑制剂处理后,JAK1在BM-Mɸ中积累,说明JAK1蛋白的降解主要依赖于蛋白酶体途径;但METTL3的缺失并不能逆转JAK1蛋白降解,这表明蛋白酶体途径不受METTL3的影响(如图C)。


无法直接建立联系时,作者又把目光聚焦在Reader蛋白身上。作者使用siRNA沉默YTHDF1的表达可以导致JAK1的蛋白水平降低(如图F) 。

RIP-qPCR和链霉亲和素RNA-pull down实验表明,YTHDF1内源性和外源性均可增强BM-Mɸ中JAK1的表达(如图G-I)。

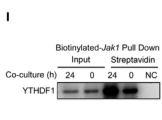
最后通过核糖体图谱从METTL3 WT和cKO BM-Mɸ中分离出不同的RNA组分:非翻译组分(<40S)、翻译起始组分(包括40S核糖体亚基、60S核糖体亚基、80S单体、<80S)和翻译活性多聚核糖体(>80S)。结果表明,cKO细胞中JAK1 mRNA在多聚核糖体中的数量明显低于WT细胞(下图J)。

到这里,关于METTL3表达水平上调后所有下游机制已经被一一解开,那么是什么原因导致METTL3表达水平上调呢?
7. 肿瘤来源的乳酸通过组蛋白乳酸化诱导METTL3表达水平上调
根据之前的相关研究发现在肿瘤微环境中乳酸积累是各种类型癌症的共同特征,因此作者检测了BM-Mɸ-MC38共培养培养基或MC38肿瘤组织中乳酸的实际浓度,在共培养培养基和MC38组织中都检测到较多的乳酸积累(如图A)。

在BM-Mɸ和BM-MDSCs的培养基中加入25 mM乳酸后,METTL3的表达显著上调(如图B、C)。

考虑到需要在表观层面影响METTL3的表达水平,那么组蛋白修饰是个很好的切入对象。BM-Mɸ-MC38共培养表现出H3K18la修饰水平升高(下图H、I);通过H3K18la抗体进行ChIP-qPCR,结果说明H3K18la富集在METTL3基因座的启动子区。这些结果表明,TME中积累的乳酸足以通过提升H3K18la修饰水平来激活METTL3的表达。

最后作者发现METTL3蛋白上也存在乳酸化修饰,并且增强了其结合RNA的能力,这里不再展开。
#
总结
组蛋白乳酸化修饰是近几年来新发现的修饰,与研究的较多的传统组蛋白修饰(H3K27ac/H3K4me3等)相比, 创新性较强,因此也是目前的热点研究。那我们总结下作者的工作:
1. TCGA数据和实验证明TIM中METTL3的表达水平增加;
2. 敲除METTL3会导致TIM向抑制肿瘤的作用转换,而且TME改变呈现出免疫抑制作用的缓解;
3. RNA-seq发现缺失METTL3后,JAK-STAT3通路活性下调;
4. meRIP-seq发现Jak1 mRNA上存在m6A修饰,且敲除METTL3后消失;
5. 敲除METTL3后并不影响JAK1的mRNA水平,通过沉默m6A reader YTHDF1可以使JAK1蛋白水平降低;通过核糖体图谱发现YTHDF1可以促进JAK1的翻译;
6. 从乳酸堆积现象入手通过ChIP-qPCR发现METTL3表达水平受H3K18la调控。

文中已有康测产品:meRIP-seq,RNA-seq
#
参考文献
Xiong et al., Lactylation-driven METTL3-mediated RNA m6A modification promotes immunosuppression of tumorinfiltrating myeloid cells, Molecular Cell (2022).
DOI: 10.1016/j.molcel.2022.02.033、
#
延伸阅读











