20221028康测助力上海交通大学医学院瑞金医院胰腺疾病研究所蒋玲曦教授团队发表 J HEMATOL ONCOL

#
研究背景
尽管近几十年来多种癌症患者的生存率大幅增加,但胰腺导管腺癌(PDAC)仍然是最致命的癌症之一,由于缺乏前期症状,PDAC通常在晚期才被诊断出来,因此会导致PDAC患者生存率一直较低。
外泌体是细胞外膜直径范围在50至150 nm的囊泡,被认为是细胞间通讯的关键信使。最近,分离自血清或血浆的外泌体标志物在肿瘤筛查中的潜在用途被研究报道。长链非编码RNA(lncRNA)是基因表达网络中的重要调节因子,参与调节mRNA稳定性、转录、翻译和翻译后修饰等多个生物学过程。通过与miRNA,mRNA,DNA或蛋白互作,lncRNA有助于癌症细胞稳态的各个方面,包括增殖、存活、迁移和基因组稳定性。此外,lncRNA可以被癌细胞释放的外泌体包装,并转移到受体细胞中以调节癌症进展。因此,外泌体中的 lncRNA 被当作早期肿瘤检测和疾病进展监测的潜在标志物。
为了寻找用于PDAC早期诊断的生物标志物并解析其在PDAC进展中的分子机制,而且和mRNA上的ac4C修饰能产生什么交集?作者开展了如下研究,其中康测科技RIP-seq为该研究助力!
#
研究结果
1.LINC00623被鉴定为PDAC患者的潜在外泌体标志物
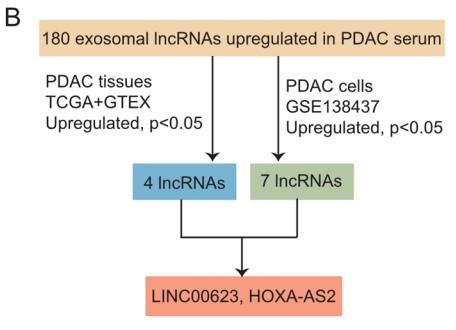
作者首先从5名PDAC患者和5名健康个体分离得到循环外泌体,并从外泌体中提取RNA用于高通量测序(RNA-seq),结果鉴定出4801个lncRNA。其中,与健康个体相比,来自PDAC患者血清样本的lncRNA有180个表达上调,148个表达下调。接着,作者根据它们在PDAC肿瘤组织和细胞系中的表达情况进一步缩小候选lncRNA的范围(Fig. 1B)。最终发现两个候选lncRNA:LINC00623和HOXA-AS2,在7种PDAC细胞系中高水平表达。
2.LINC00623高水平表达与临床意义的关系
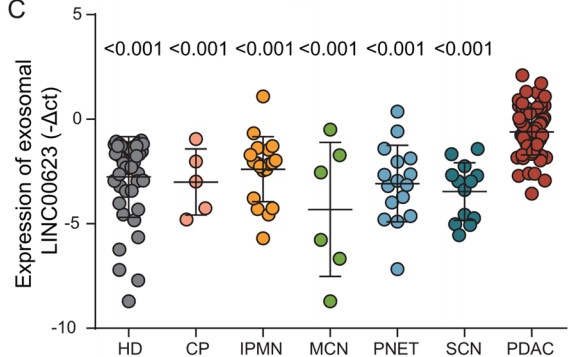
作者利用RT-qPCR检测上述两种候选外泌体lncRNA在患者群体中的表达,结果发现:PDAC患者(n = 73)的外泌体LINC00623的表达水平显著高于健康个体(n = 42),胰腺良性肿瘤患者外泌体LINC00623的表达水平则与健康个体相似 (Fig. 1C)。然而,胰腺疾病患者和PDAC患者之间外泌体HOXA-AS2的表达水平并无显著差异。因此,作者选择LINC00623进行进一步研究。
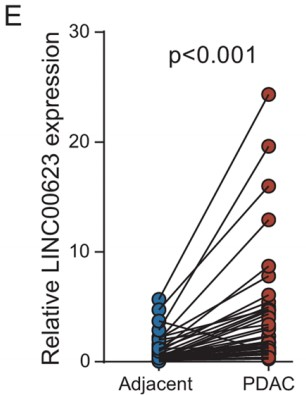
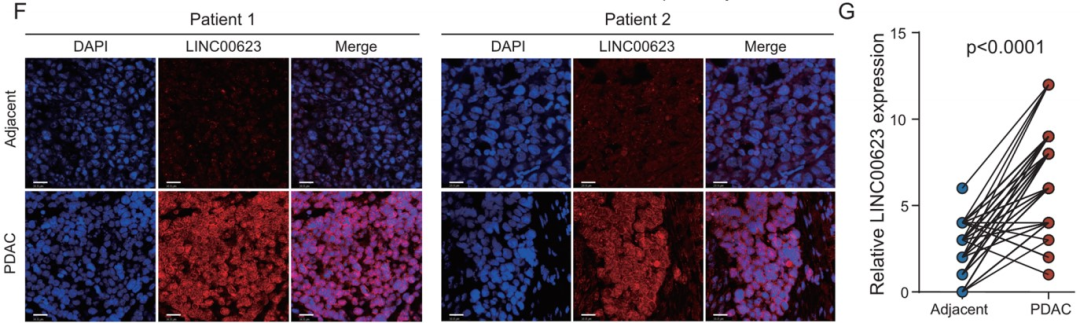
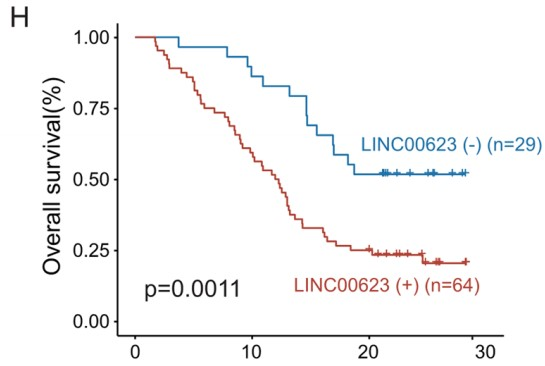
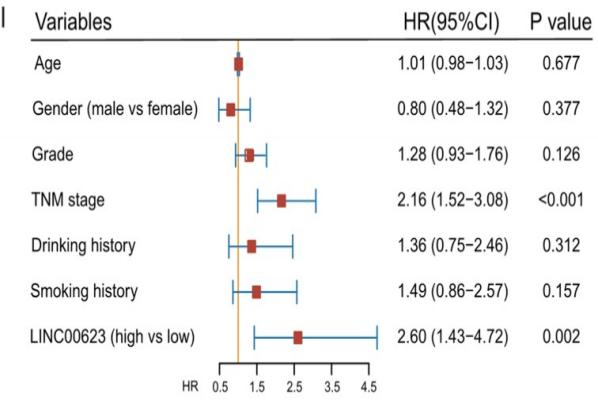
接着,作者利用RT-qPCR检测了LINC00623在细胞系和40对PDAC组织中的表达情况。与公共数据集(GSE15471和TCGA)的结果一致,LINC00623在肿瘤组织和PDAC细胞系中的表达上调 (Fig. 1E)。随后,作者对由93对PDAC和非肿瘤标本组成的组织微阵列(TMA)进行荧光原位杂交染色(FISH)以进一步测定LINC00623的表达(Fig. 1F–G)。PDAC患者根据FISH评分被分为两组,而一项临床相关的研究发现,LINC00623的表达与组织学分级显著相关。此外,Kaplan‒Meier生存分析表明,LINC00623的表达与较差的总生存率显著相关(Fig. 1H)。Cox比例风险回归分析显示,LINC00623的表达是PDAC患者总生存期的独立预后因素 (P=0.002, Fig. 1I)。
3.LINC00623可以促进PDAC肿瘤发生和转移
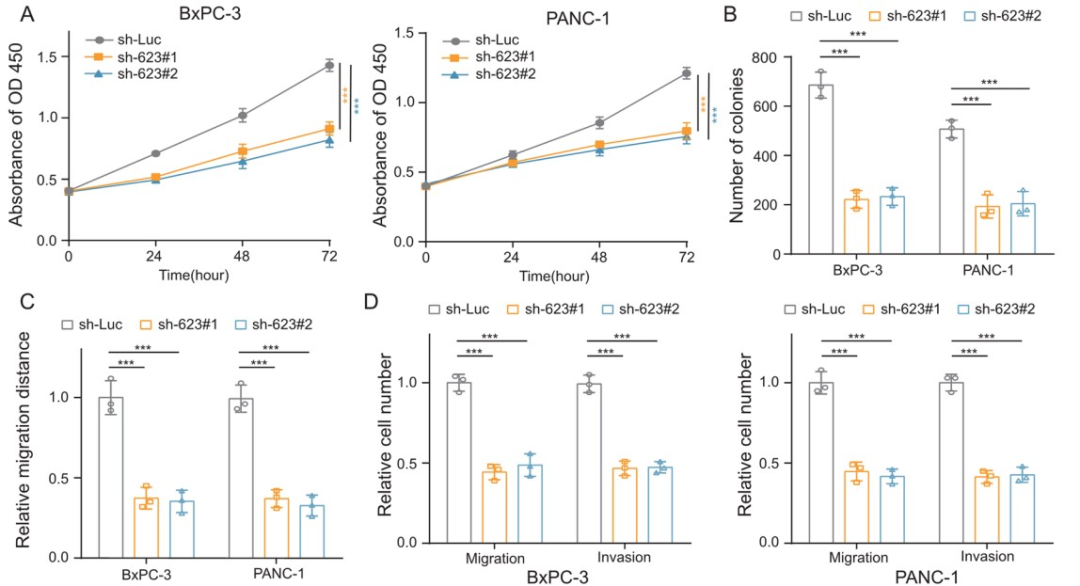
为了研究LINC00623在PDAC中的功能,作者使用两种PDAC细胞系(BxPC-3和PANC-1)进行体外和体内功能测定,并利用shRNA使LINC00623表达沉默,利用dCAS9-SAM系统使LINC00623过表达;体外功能测定结果表明,LINC00623表达沉默显著抑制细胞增殖(Fig. 2A)、病灶形成(Fig. 2B)、细胞流动性(Fig. 2C)、细胞迁移和侵袭(Fig. 2D)。
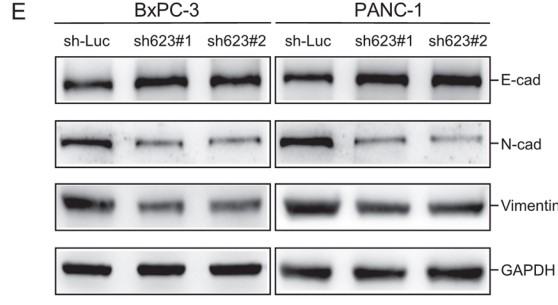
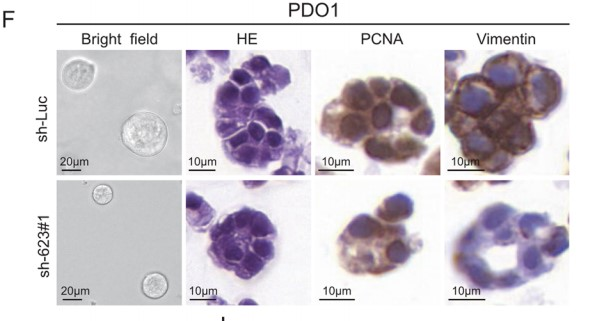
WB结果则显示,LINC00623过表达使上皮标志物E-cadherin的表达下调,使间充质标志物N-cadherin和Vimentin的表达上调(Fig. 2E)。此外,作者还构建了两个PDAC患者来源的类器官(PDO)模型,并通过H&E和IHC染色发现:LINC00623表达沉默不仅使类器官变小了,还降低了PDO的细胞增殖速率(由PCNA表达决定)和EMT标记物(Vimentin)的表达(Fig. 2F)。
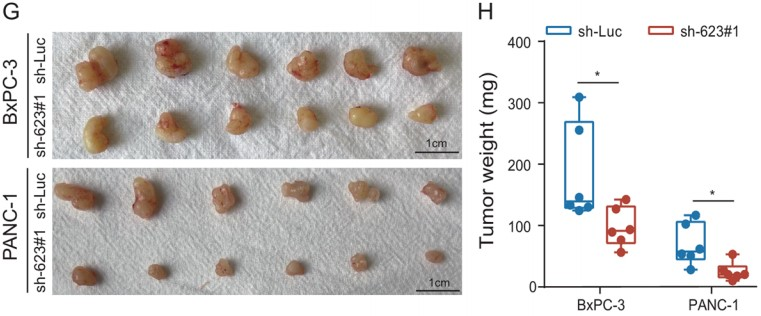
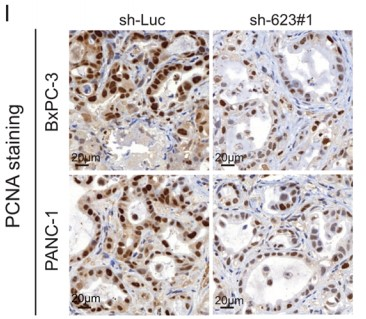
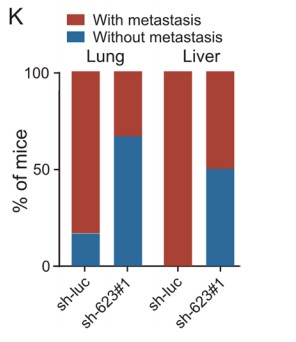
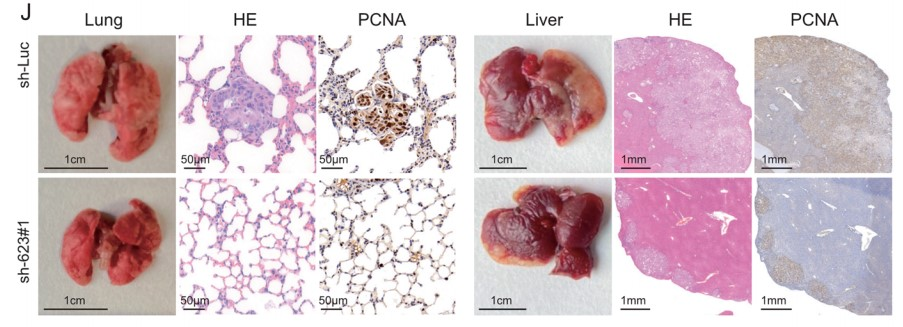
为了测试LINC00623在体内的致瘤能力,作者将LINC00623表达沉默的PDAC细胞和载体转染的对照细胞分别接种到BALB/c裸鼠的左背鳍和右背鳍中。结果表明,由LINC00623表达沉默细胞形成的肿瘤小于对照细胞形成的肿瘤(Fig. 2G–H)。由于在LINC00623表达沉默细胞形成的肿瘤中观察到较少的PCNA阳性细胞(Fig. 2I),作者推测LINC00623表达沉默细胞形成的肿瘤体积减少可能是由细胞增殖速率降低导致。最后,作者通过两次体内转移实验,验证了LINC00623在PDAC转移中的作用。在尾静脉注射实验中,注射了LINC00623表达沉默细胞的6只小鼠中,有1只小鼠在肺表面观察到转移性结节,而注射了对照细胞的6只小鼠中,有4只观察到转移性结节;与肺转移结果一致,在注射了LINC00623表达沉默细胞(3/6只小鼠)和对照细胞(6/6只小鼠)的小鼠肝脏中观察到多个转移性肿瘤结节(Fig. 2J–K)。
4.LINC00623可以结合ac4C乙酰化酶NAT10
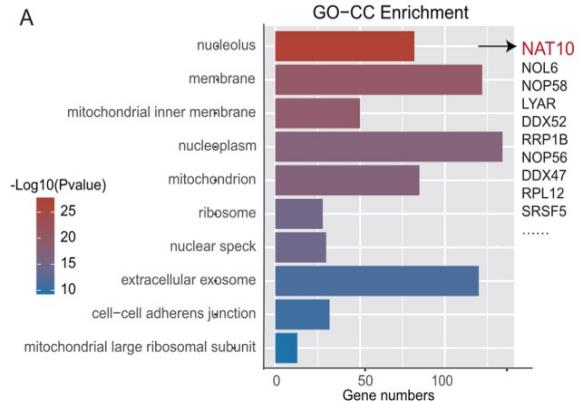
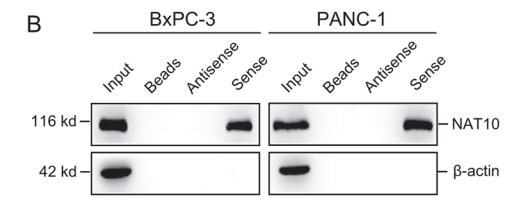
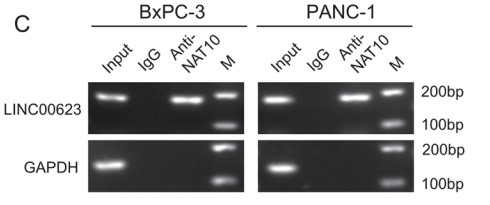
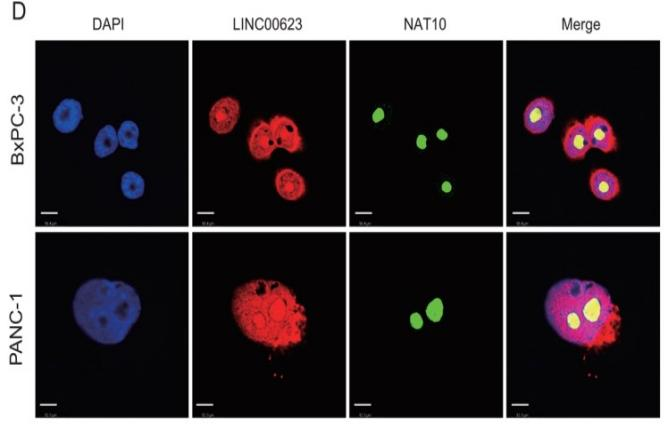
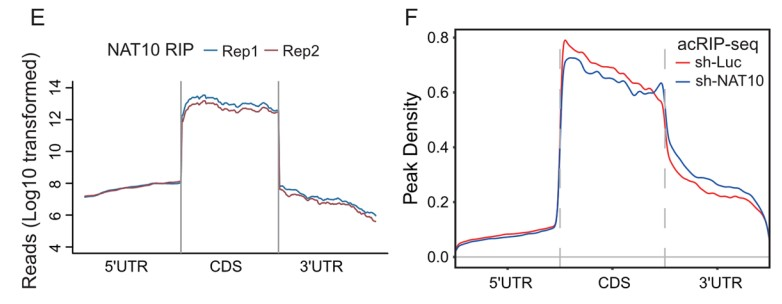
lncRNA的功能与其亚细胞定位密切相关。因此,作者首先对LINC00623的亚细胞定位进行探索,BxPC-3细胞中的单分子RNA FISH结果表明,大约70%的LINC00623分子定位在细胞核中。核质分离实验则进一步证实了LINC00623的核定位。作者推测LINC00623可能与核特异性蛋白发生相互作用。于是作者利用RNA pull-down实验鉴定PDAC细胞中与LINC00623互作的蛋白。使用SDS‒PAGE分离富集的蛋白并进行质谱分析,大约433种潜在互作的蛋白被鉴定出来。GO-CC分析显示大多数蛋白定位在细胞核中,包括NAT10 (Fig. 3A)。LINC00623转染的两个PDAC细胞系的RNA pull-down产物中同样鉴定到NAT10 (Fig. 3B)。对NAT10 RIP后RNA进行RT-PCR 可以检测到LINC00623 (Fig. 3C)。IF实验结果也证实了LINC00623和NAT10的共定位 (Fig. 3D)。
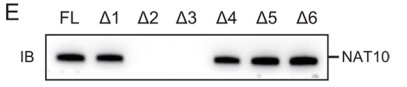
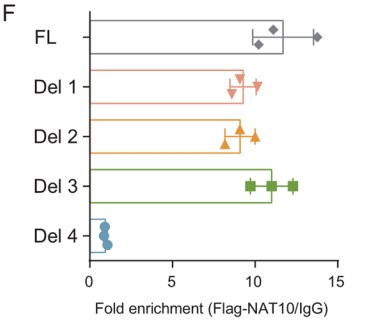
最后,作者基于LINC00623的二级结构构建了一系列缺失突变体(Δ1: 1–699 bp; Δ2: 700–1200 bp; Δ3: 1201–1800 bp; Δ4: 1801–2500 bp; Δ5: 2501–3000 bp; Δ6: 3001–3607 bp) (Fig. 3E),并使用FLAG标记的全长和截断的NAT10蛋白进行RIP实验,结果表明缺少NAT10结合结构域(753–1025 aa)的缺失突变体未能与LINC00623发生相互作用(Fig. 3F)。上述结果证实LINC00623结合NAT10。
5.LINC00623 结合后可以阻断 NAT10 泛素化后的降解过程
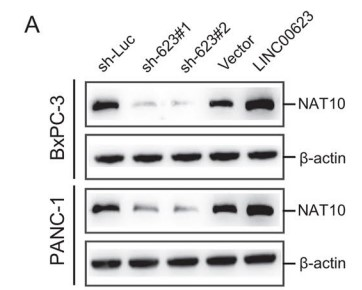
作者完成验证LINC00623和NAT10可以结合后,下一步想观察LINC00623是否能调控NAT10的mRNA水平。有趣的是,LINC00623与NAT10 mRNA水平没有太大的关联;但是沉默LINC00623表达时,NAT10的蛋白表达水平显著降低,而过表达LINC00623时,NAT10的蛋白表达水平增加 (Fig. 4A)。作者进一步用蛋白合成抑制剂环己酰亚胺(CHX)处理后,沉默LINC00623表达降低了NAT10蛋白的半衰期 (Fig. 4B)。
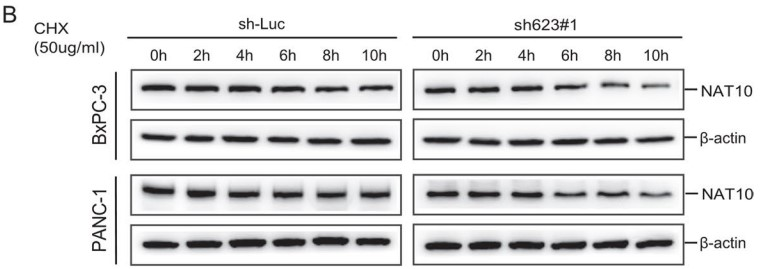
泛素-蛋白酶系统和溶酶体途径在细胞内蛋白水解中起着重要作用。蛋白酶抑制剂MG132,而非自噬抑制剂氯喹(CQ),消除了溶酶体蛋白降解,沉默LINC00623表达后可以导致PDAC细胞中NAT10蛋白的积累(Fig. 4C),这表明LINC00623可能抑制PDAC细胞中NAT10的泛素化依赖的蛋白降解途径。
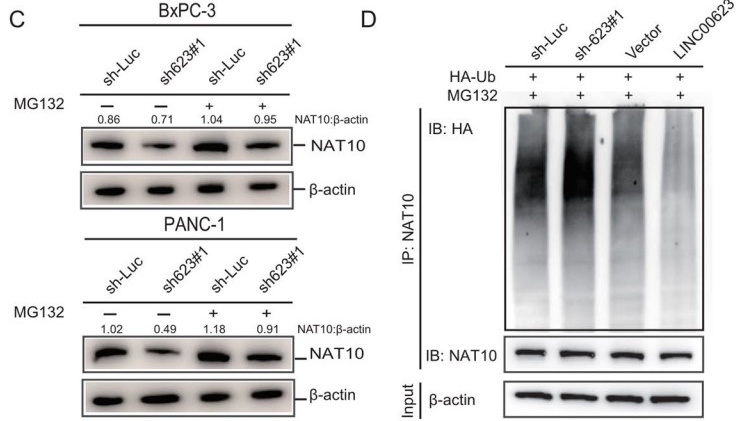
和预期一致,在沉默LINC00623表达的细胞中,NAT10的泛素化水平显著升高,而在过表达LINC00623的细胞中NAT10的泛素化水平降低(Fig. 4D)
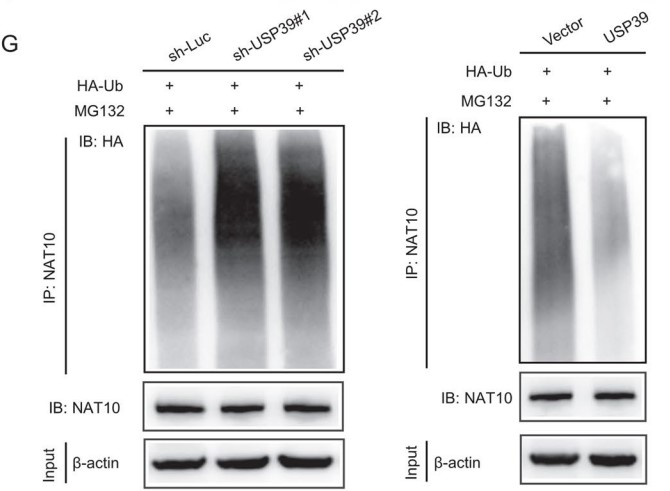
据其他研究报道,lncRNA可以在蛋白质泛素化的过程中充当蛋白质复合物的骨架,因此作者在433种潜在的LINC00623互作蛋白中,鉴定出两种去泛素化酶(USP39和PRRF8)。而之前的一项研究表明,NAT10能与USP39发生免疫共沉淀。于是作者假设LINC00623作为一个组装骨架,促进NAT10和USP39之间的互作,抑制NAT10的泛素化和降解:首先,作者利用USP39 RIP 和 LINC00623 pull-down检测,确定了LINC00623与USP39之间的互作,同时在两个PDAC细胞系中也观察到它们的共定位。此外,Co-IP和IF实验表明,NAT10能与USP39发生物理相互作用和共定位,并且这种相互作用取决于LINC00623的表达水平(Fig. 4E、F)。
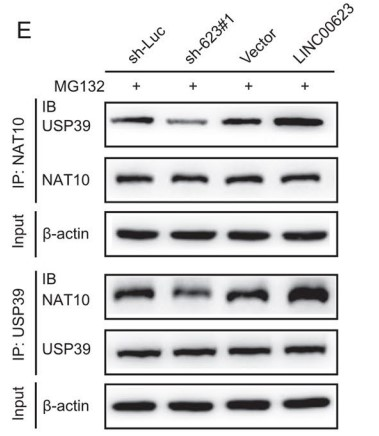
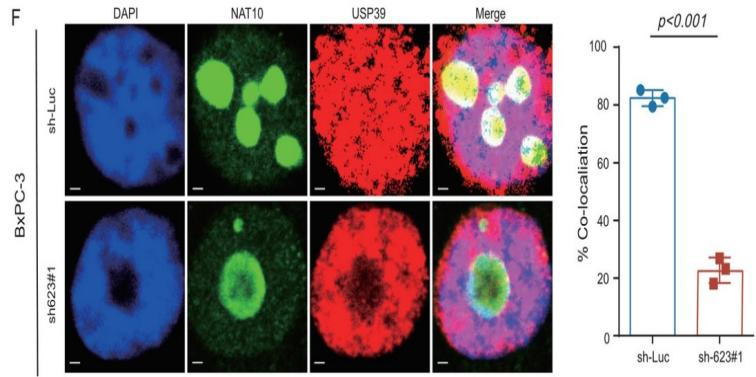
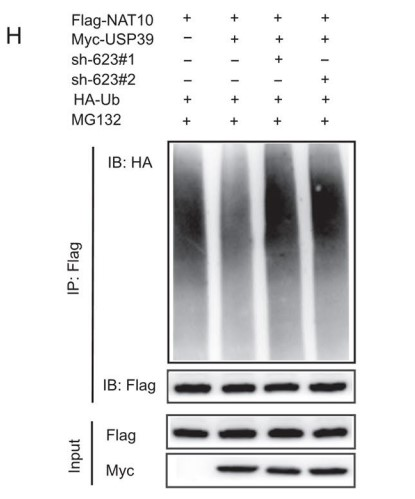
接着作者还探索了USP39表达对NAT10泛素化的影响。结果显示NAT10的泛素化水平与USP39的表达水平呈负相关(Fig. 4G)。最后,作者利用位点突变C306A除去USP39去泛素酶活性,随后将USP39位点突变体(C306A)和USP39野生型(WT)构建载体并瞬转两个PDAC细胞系。结果发现:使用USP39位点突变(C306A)构建体转染的细胞中NAT10的蛋白表达水平低于用WT构建体转染的细胞。而在过表达USP39后,即使沉默LINC00623表达,PDAC细胞中NAT10的泛素化水平仍然升高 (Fig. 4H)。综上所述,LINC00623扮演NAT10与USP39互作时的骨架,通过阻断NAT10的泛素化依赖的蛋白降解途径来增加NAT10蛋白的稳定性。
6.NAT10通过重塑mRNA的N4-乙酰胞苷(ac4C)修饰,扮演LINC00623的下游调控中介
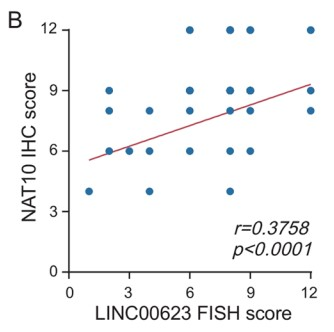
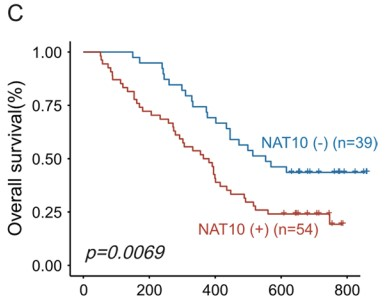
作者通过对93对PDAC组织和相邻非肿瘤组织进行IHC染色,发现在肿瘤组织中检测到的NAT10表达水平高于非肿瘤组织 (Fig. 5A)。而且在PanIN组织中也观察到强烈的阳性信号,这表明NAT10可能在PDAC的发育和进展中发挥作用。同时,作者发现NAT10的蛋白表达水平与LINC00623的表达水平呈正相关 (Fig. 5B)。此外,NAT10的表达水平越高,总生存率越低,两者显著相关(Fig. 5C)。

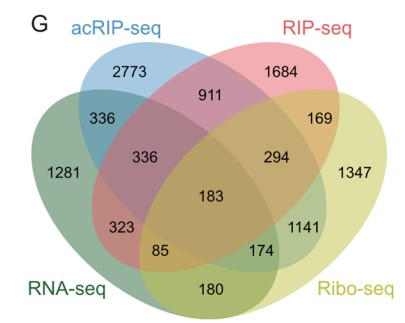
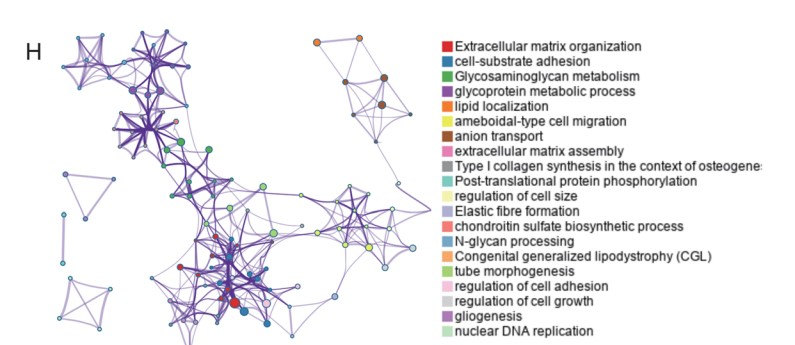
作为唯一已知的ac4C修饰的Writer,NAT10对mRNA稳定性和翻译的调节具有关键影响。为了获得NAT10介导的ac4C修饰调控的基因,作者整合敲低NAT10细胞的NAT10 RIP-seq、acRIP-seq、RNA-seq和Ribo-seq数据(Fig. 5D)。根据NAT10 RIP-seq 和 acRIP-seq 结果,NAT10 和 ac4C 修饰广泛分布在 CDS 区(Fig. 5E, F)。随后,作者将NAT10 RIP-seq 中富集的基因集划分为Group 1 (Fig. 5G)。将acRIP-seq数据中,在亲本细胞而不在NAT10敲低细胞中富集的基因集定义为Group 2(Fig. 5G)。将RNA-seq中,具有不同表达水平的基因集被划分为Group 3(Fig. 5G)。此外,为了探索ac4C对mRNA翻译效率的影响,作者利用Ribo-seq测定转录组中核糖体的占用情况,并将Ribo-seq数据中,翻译效率存在显著差异的mRNA集被定义为Group 4(Fig. 5G)。接着,作者将Group 1-4取交集,鉴定到183个基因。GO富集分析显示,这些基因中的大多数在细胞生长,细胞粘附和细胞外基质组织的通路中富集(Fig. 5H),此外,在这183个基因中,有12个已被其它研究证明有助于PDAC的肿瘤发展。
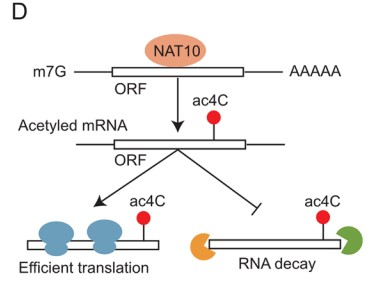
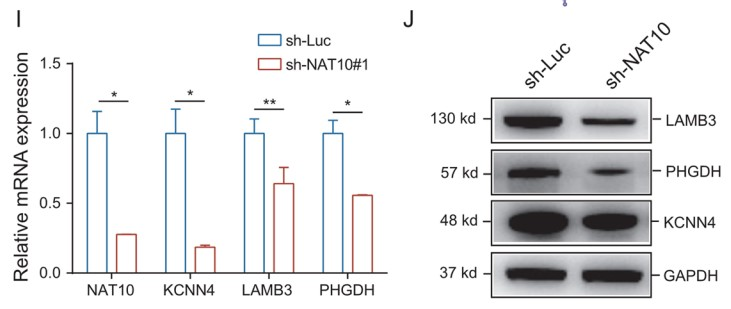
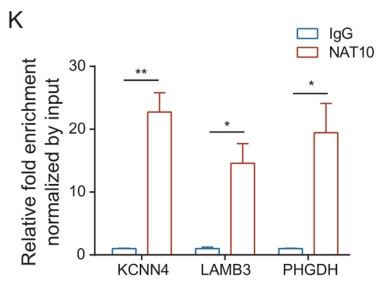
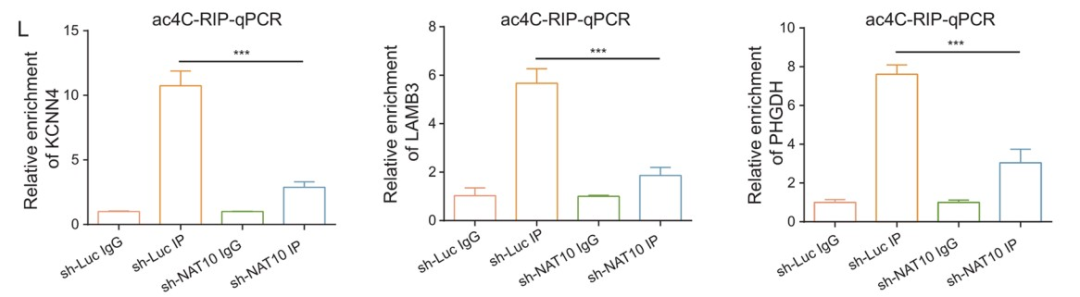
RT-qPCR和WB结果表明,NAT10敲低后,MUC4、LAMB3和PHGDH表达水平显著降低 (Fig. 5I, J)。此外,对照细胞中KCNN4、LAMB3 和 PHGDH mRNA上有ac4C修饰的peak,并且这些peak在NAT10敲低的细胞中消失。NAT10 RIP和随后的RT-qPCR结果证明,这些定义的ac4C靶标与NAT10有显著相互作用(Fig. 5K)。最后,作者利用RT-qPCR 检测 acRIP产物中 KCNN4、LAMB3 和 PHGDH mRNA的相对富集情况,结果发现在NAT10敲低细胞中三个基因的ac4C靶标区域的扩增减少(Fig. 5L)。此外,MUC4、LAMB3和PHGDH在肿瘤组织中的表达水平明显高于非肿瘤组织。综上所述,LINC00623对PDAC的影响取决于NAT10,NAT10重塑了PDAC中的ac4C修饰水平,其可以维持与癌症相关基因mRNA的稳定性并促进了它们的翻译效率。
7.LINC00623是PDAC的潜在治疗靶点
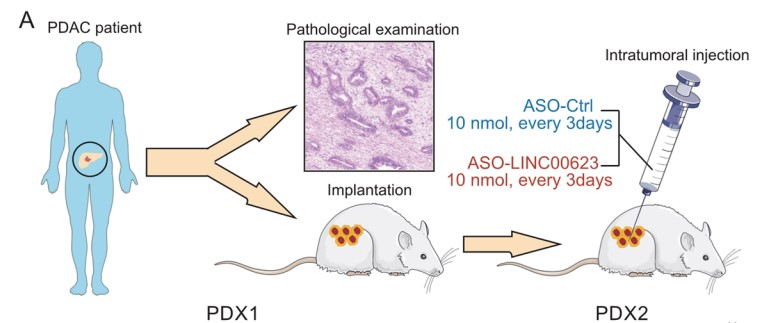
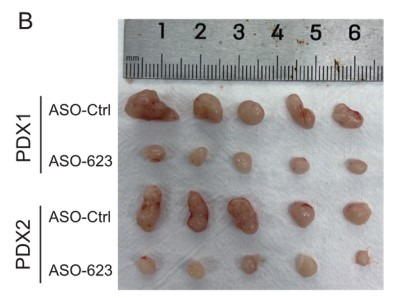
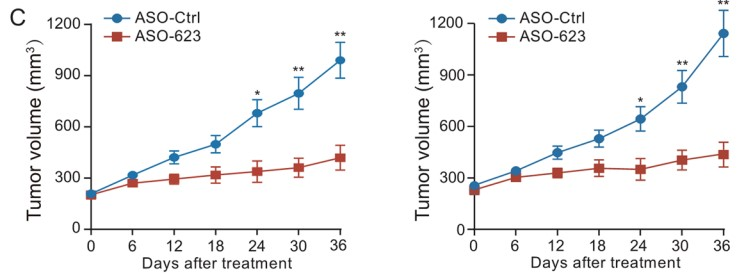
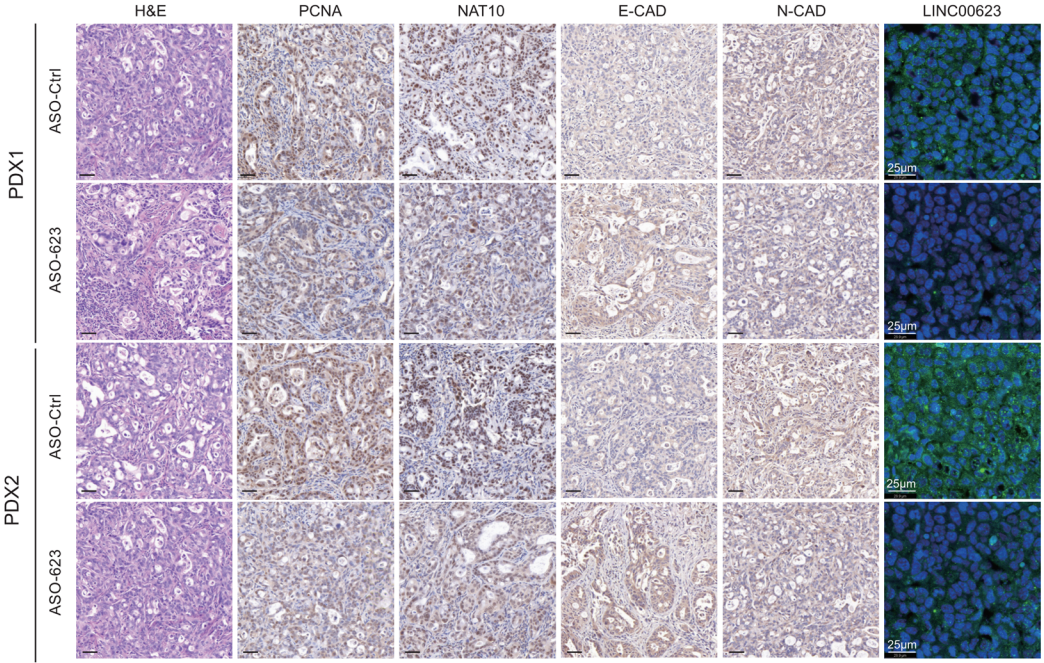
由于LINC00623在PDAC致瘤性中起着重要的作用,作者最后研究了LINC00623作为PDAC治疗靶点的潜在用途。首先,作者使用高表达LINC00623的PDAC构建PDX模型(Fig. 6A)。随后作者将LINC00623抑制剂(ASO-LINC00623)通过肿瘤内注射给药到 PDX模型。结果发现ASO-LINC00623显著降低了两种PDX模型中的肿瘤负荷(Fig. 6B, C)。此外,如 H&E 和 IHC 染色结果所示,ASO-LINC00623 显著降低了 LINC00623的表达、细胞增殖和 EMT,这可能与NAT10的蛋白表达水平降低有关(Fig. 6E, F)。
#
研究总结
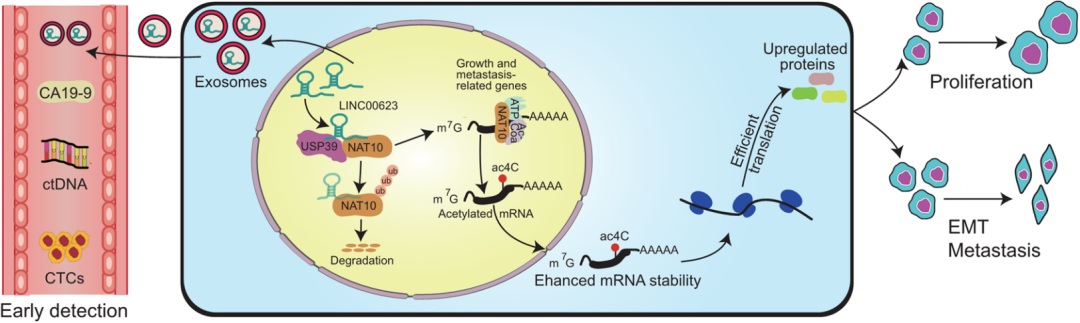
1. 通过对PDAC患者的循环外泌体进行LncRNA-seq,鉴定到一个新的致癌性lncRNA LINC00623,且LINC00623表达水平明显高于正常人;
2. 通过对LINC00623的RNA pull-down,获得潜在互作的蛋白NAT10并加以验证;
3. 敲低/过表达LINC00623对NAT10 mRNA水平没有影响,但是对NAT10蛋白水平有影响;
4. 通过蛋白酶抑制剂发现LINC00623与NAT10泛素化依赖蛋白酶降解途径有关;
5. 再次通过RNA pull-down结果发现LINC00623可以结合去泛素化酶USP39、并确定其可以充当 NAT10与USP39互作的骨架、从而维持NAT10蛋白的稳定性;
6. 通过RIP-seq、acRIP-seq、mRNA-seq和Ribo-seq四种组学证明稳定的NAT10,可以重塑 PDAC中与致癌相关mRNA的ac4C修饰水平,增强其稳定性和翻译效率,从而促进肿瘤增殖、致瘤、迁移和侵袭能力。
7. 通过体内实验证明LINC00623为新的治疗靶点。
#
参考文献
Zengyu Feng, Kexian Li, Lingxi Jiang, et al. The LINC00623/NAT10 signaling axis promotes pancreatic cancer progression by remodeling ac4C modifcation of mRNA[J]. Journal of Hematology & Oncology, 2022











