20220916文献解读 | SF3B1促进HIF1信号转导和胰腺癌的恶性发展

研究背景

SF3B1是U2小核核糖核蛋白(snRNP)复合物的核心成分,参与RNA剪接中分支点序列的识别和选择。该基因的错义突变常见于多种不同的血癌(例如,骨髓增生异常综合征、慢性淋巴细胞白血病)和实体瘤(例如,乳腺癌、胰腺癌、葡萄膜黑色素瘤)中,导致异常的3’剪接位点被使用,从而产生新的 isoforms和/或导致数百个基因发生无义介导的衰减。而如MAP3K7、PPP2R5A等基因的错误剪接则被证明会促进肿瘤的恶性发展。同时最近的研究还发现,野生型SF3B1表达水平与胰腺癌、子宫内膜癌、前列腺癌、肝癌和乳腺癌的侵袭性之间存在联系,SF3B1较高的表达与不良预后相关。考虑到心脏中,SF3B1过表达是由缺氧诱导的,而实体瘤通常含氧不足,因此作者假设野生型 SF3B1表达上调有助于肿瘤细胞适应缺氧状态,并促进肿瘤的发展。为了验证猜想,作者利用ChIP-seq开展了如下实验。
研究结果

1.SF3B1是HIF靶基因,可正向调控HIF通路活性
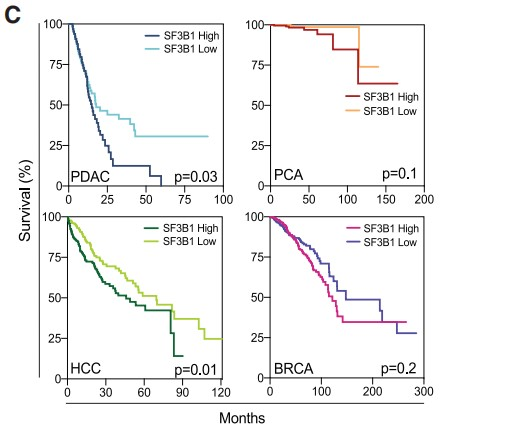
之前的研究中作者观察到在缺血性心脏病中SF3B1受HIF信号通路调节。因此,作者猜测在癌症中SF3B1同样可能是HIF靶基因,于是作者首先分析了胰腺导管腺癌 (PDAC)、前列腺癌(PCA)、肝癌(HCC)和乳腺癌(BRCA)四种不同实体瘤的RNA-seq数据,结果显示SF3B1表达与HIF信号传导的两个关键成分HIF1A和ARNT(HIF1B)密切相关(Figures 1A and 1B),并且SF3B1表达越高的患者生存期越短 (Figure 1C)。
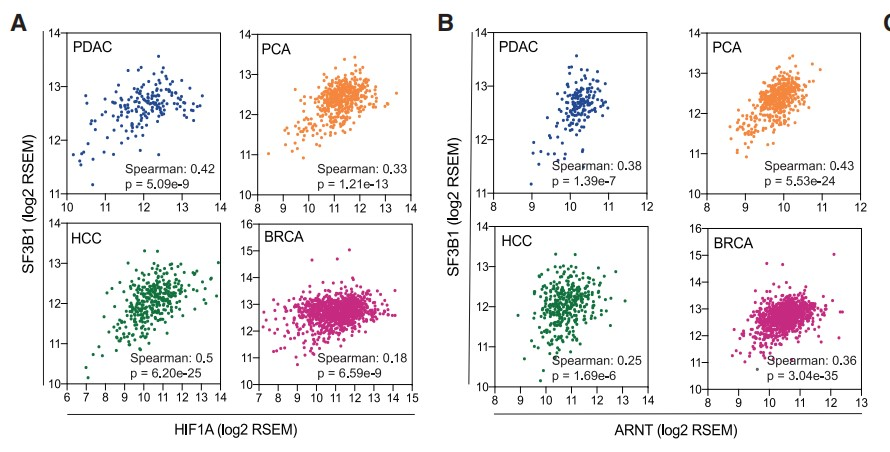
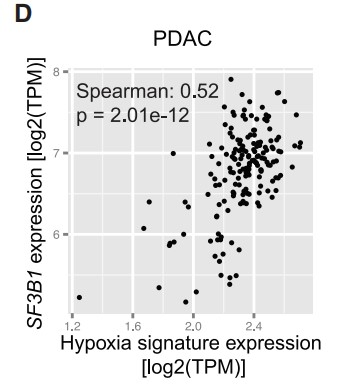
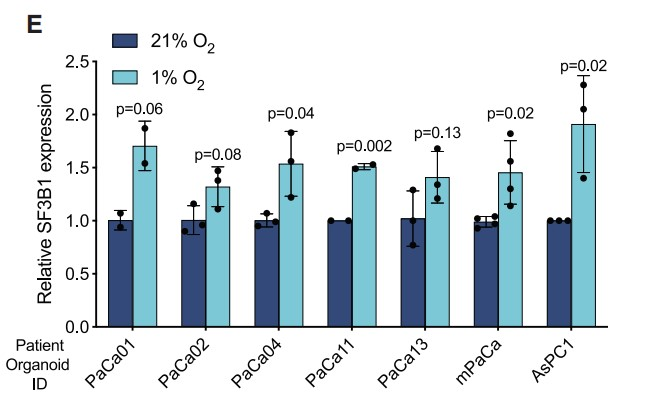
接着作者专注于PDAC(该癌症类型因缺氧环境闻名),并在人PDAC样本中观察到34个已知HIF靶基因的平均表达与SF3B1表达之间存在较强的相关性( Figure 1D)。随后作者使用一组患者来源的PDAC类器官和细胞系,在实验诱导缺氧条件下检测到SF3B1的表达显著上调 (Figures 1E)。此外,ChIP-qPCR结果显示:PANC-1细胞中HIF1α结合到SF3B1的启动子区域(Figure 1F),上述结果表明:在PDAC中,SF3B1是HIF靶基因。

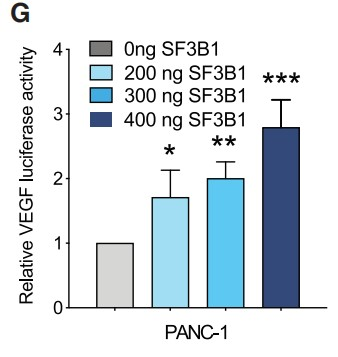
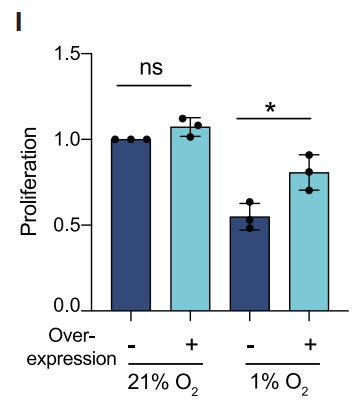
最后作者对SF3B1是否还是HIF1信号传导的调节因子进行了验证,通过过表达、siRNA介导的敲低和单等位基因敲除等手段调控人PDAC细胞系和患者来源PDAC类器官中SF3B1的表达水平,结果表明:SF3B1的过表达导致基于VEGF-荧光素酶HIF报告基因活性以浓度依赖性方式增加 (Figures 1G),并且已知HIF靶基因(BNIP3,CA9,EGLN3,GLUT1,VEGFA)的表达上调(Figure 1H),而SF3B1表达水平的降低则导致这些靶基因显著下调(Figure 1H)。此外,在对缺氧敏感的Mia-Pa-Ca-2细胞中,SF3B1的过表达增加了缺氧状态下细胞的增殖率,而在正常氧状态下却没有发现该现象 (Figure 1I)。同样,SF3B1的敲低也导致黑色素瘤、BRCA和嗜色性肾细胞癌(ChRCC)细胞系中HIF靶基因响应显著降低。综上所述,作者发现SF3B1不仅是HIF靶基因,而且还是HIF1信号传导的调节因子。

2.SF3B1与HIF1α发生物理性相互作用
众所周知,SF3B1是一种剪接因子。作者推测SF3B1水平降低会导致HIF1亚基的错误剪接从而影响缺氧信号传导。为了验证该猜想,作者分析了siRNA介导的SF3B1敲低的PANC-1细胞中HIF1A和HIF1B的剪接情况,结果显示SF3B1表达下调,HIF1A的剪接没有发生改变,但HIF1B中isoform发生由变体1到变体3的转变,缺失框内外显子5。随后,作者在SF3B1耗尽的AsPC-1-,BxPC-3-和PANC-1细胞中过表达isoform 1但没能挽救HIF靶基因的活性,并且pladienolide B对SF3B1剪接活性的特异性抑制也没有导致缺氧诱导下PANC-1细胞中基于VEGF-荧光素酶的HIF报告基因活性降低。这些结果表明:SF3B1通过不依赖剪接的方式调控HIF信号传导。
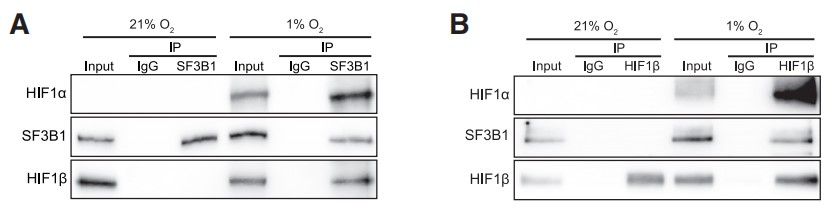
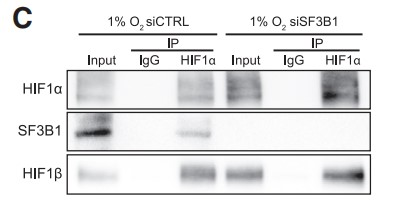
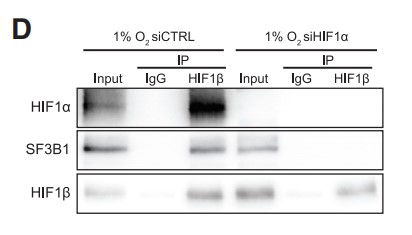
免疫共沉淀(Co-IP)结果表明,在缺氧条件下,SF3B1与HIF1α/HIF1β转录复合物结合 (Figures 2A and 2B,2A使用SF3B1抗体,2B使用HIF1β抗体)。虽然特异性siRNA介导的SF3B1耗竭并不影响HIF1β与HIF1α的结合(Figures 2C,2C使用HIF1α抗体),但siRNA介导的HIF1α耗竭却阻止了SF3B1与HIF1β的免疫共沉淀(Figures 2D,2D使用HIF1β抗体)。这些数据表明,SF3B1通过HIF1α与HIF1α-HIF1β异源二聚体相互作用,但这种结合对于HIF1α-HIF1β异源二聚体的形成并不重要。
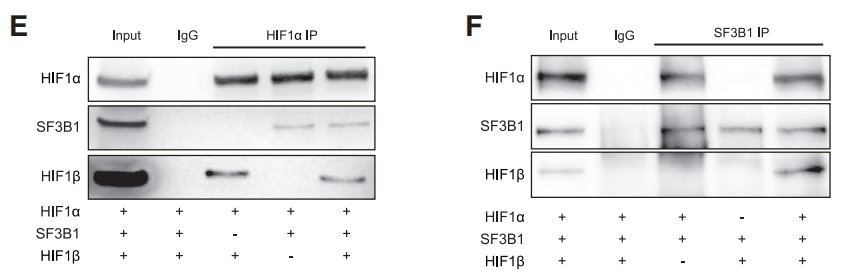
接着作者借助Sf9真核表达系统纯化重组链球菌标记的SF3B1、HIF1α和HIF1β蛋白,混合后分别用HIF1α、SF3B1抗体进行IP实验,结果显示:无论HIF1β是否存在,SF3B1与HIF1α都能发生免疫共沉淀 (Figures 2E and 2F)。
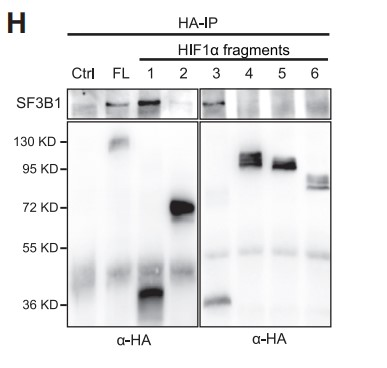
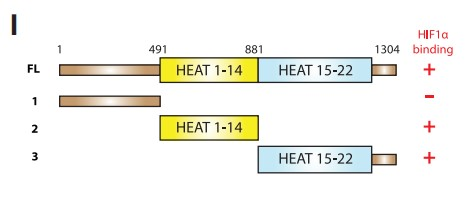
为了确定HIF1α中介导与SF3B1结合的相关域,作者生产了一系列血凝素(HA)标记的HIF1α缺失突变体,并将其与内源性SF3B1进行免疫共沉淀 (Figure 2G)。结果表明,bHLH-PAS-A-PAS-B结构域对于HIF1α与SF3B1形成复合物是必要的(Figure 2H)。此外,当使用HA标记的SF3B1缺失突变体与内源性HIF1α进行免疫共沉淀时,作者发现SF3B1的HEAT重复序列与HIF1α发生强烈相互作用,但N端结构域则没有(Figures 2I and 2J)。


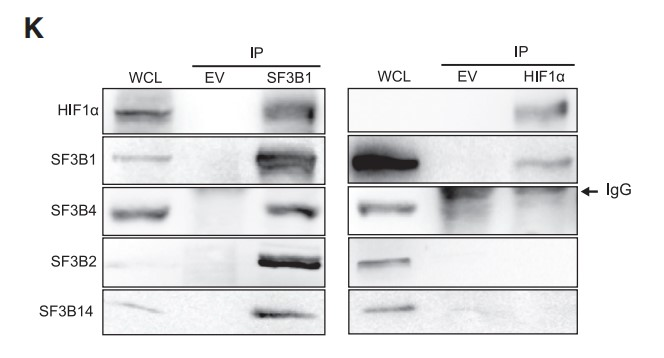
最后,作者还从缺氧的HEK293细胞中免疫沉淀SF3B1和HIF1α,并通过免疫印迹检测U2 snRNAP复合物的核心组分的存在。作者发现只有SF3B1,而非HIF1α,印迹出U2组分SF3B2,SF3B4和SF3B14 (Figure 2K)。以上结果说明,SF3B1通过结合HIF1α而与HIF1复合物发生物理相互作用,从而调控HIF信号传导。
3.HIF1与HRE元件结合需要SF3B1参与
亚细胞蛋白分离实验结果表明,siRNA介导的SF3B1的敲低导致染色质结合的HIF1α减少,但HIF1α总量不受影响 (Figures 3A)。而ChIP 实验结果则显示:缺氧条件下SF3B1会与各种 HIF靶基因的缺氧响应元件(HRE)结合,而在敲低HIF1α后结合被解除。同样,在HEK293和PANC-1细胞中,siRNA介导的SF3B1耗尽后,HIF1α和HIF1β与HREs的缺氧依赖性结合显著降低。

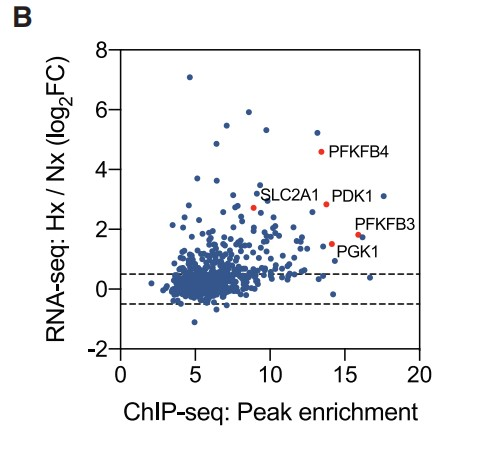
为了更深入地评估HIF1 DNA结合对SF3B1的依赖性,作者对用SF3B1靶向siRNA或对照siRNA处理的缺氧PANC-1细胞进行了HIF1α ChIP-seq,并在三个对照重复中鉴定到740个高可信度的Peaks。其中,有192个Peaks定位于在缺氧的PANC-1细胞中转录上调的基因座附近(±3 kb) (Figure 3B)。10个最明显的peaks中有6个位于已知的HIF1靶标ENO1,BNIP3L,PFKFB3,PGAM1,PGK1和PDK1的转录起始位点(TSS)区域。此外,de novo motif分析可以鉴定到RCGTG序列(HRE元件的moitf)(Figure 3C)。
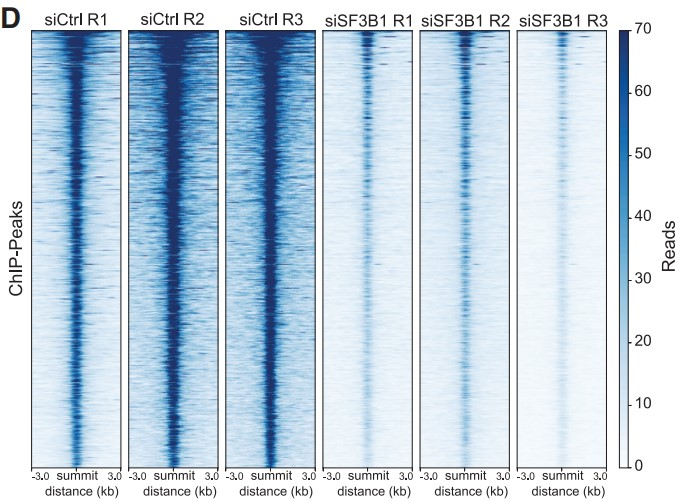
作者还观察到SF3B1敲低时HIF1α ChIP-seq峰高度大幅降低 (Figures 3D and 3E),740个已鉴定的peaks中有99.73%显著降低。
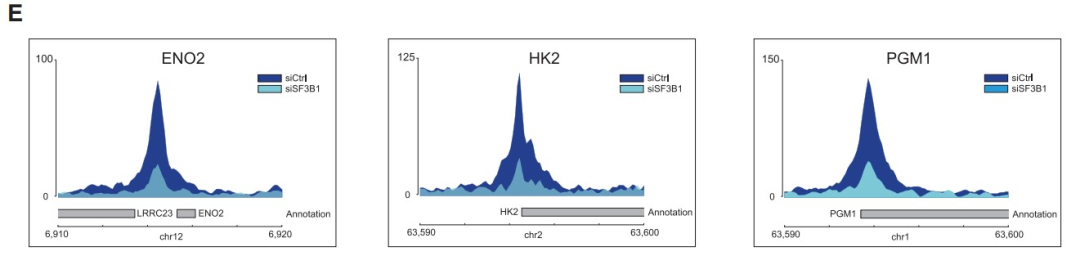
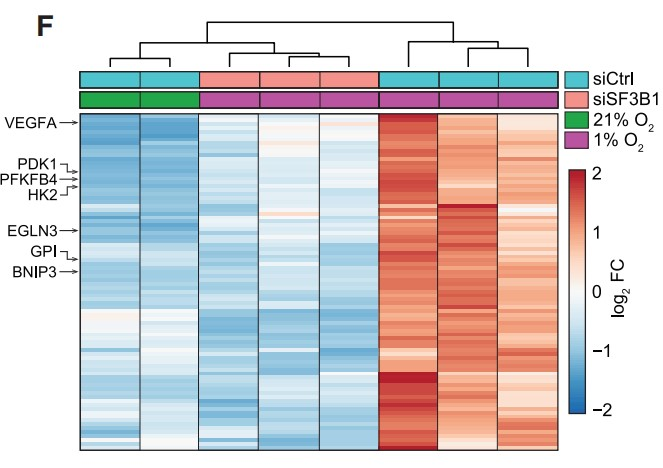
结合RNA-seq数据,作者进一步确定了192个直接HIF1α靶基因中的86个基因,这些基因依赖于SF3B1,并在缺氧条件下转录上调(Figure 3F)。并且通路分析证实上述基因在HIF1转录活性和葡萄糖代谢途径有富集 (Figure 3G)。综上所述,HIF1与HREs的DNA结合需要SF3B1,SF3B1对细胞的缺氧代谢适应十分重要。
4.Sf3b1的杂合性使HIF信号转导遇阻来限制PDAC的生长
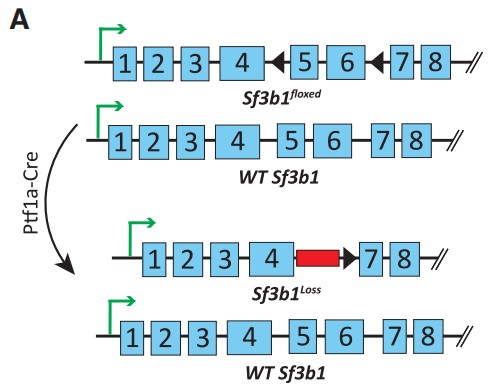
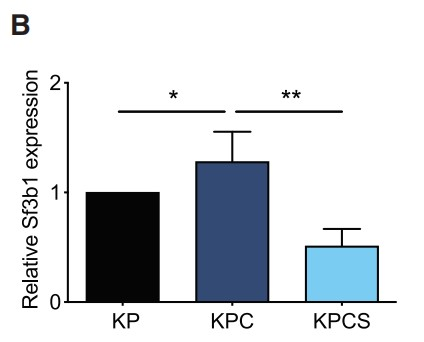
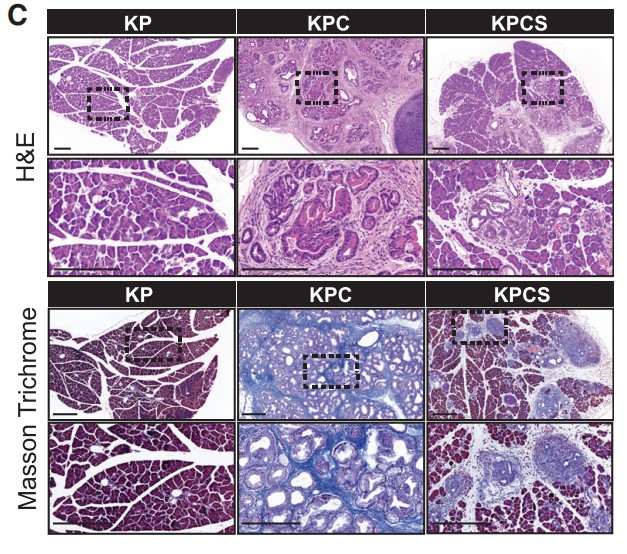
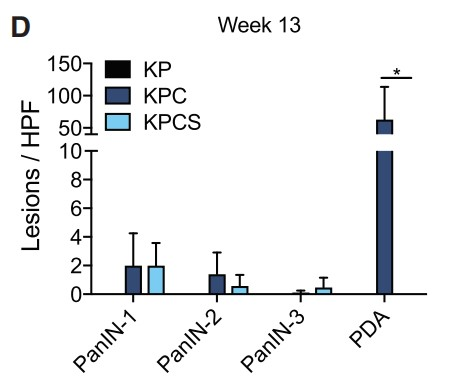
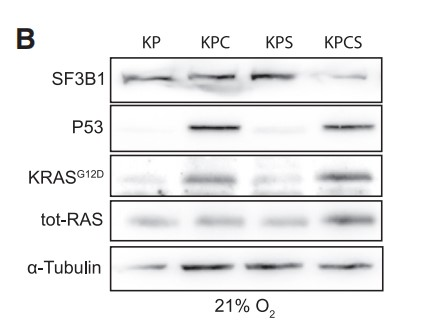
为了研究SF3B1介导的HIF调控对PDAC的重要性,作者通过Sf3b1的杂合缺失降低SF3B1表达水平,并成功构建了一个Sf3b1敲除小鼠模型(Figure 4A)。等位基因导入到KPC(LSL-KrasG12D/+;LSL-Trp53R172H/+; Ptf1a-Cre)小鼠中,致癌性KrasG12D和Trp53R172H(人TP53肿瘤驱动突变的同源物)的胰腺特异性激活,并在9-14周内驱动PDAC发展。如预期所料,胰腺中Sf3b1的纯合子缺失是不可行的,KPC背景(KPCS)中的杂合缺失导致Sf3b1基因表达和蛋白质水平显著降低(Figures 4B)。虽然在非致癌 Ptf1a-Cre 背景中的 Sf3b1+/- 小鼠中未观察到胰腺的解剖外观和重量异常,但在 KPC背景中,Sf3b1的杂合缺失导致显著的形态学差异。7周龄时,60%的KPC小鼠, 2%的KPCS小鼠出现胰腺上皮内瘤变 (PanIN) 病变,13周龄时,100%的KPC小鼠出现PanIN病变或PDAC,而只有60%的KPCS小鼠出现1级或2级PANIN病变(Figures 4C, 4D)。此外,KPC小鼠出现更大的肿瘤,生存期显著缩短(Figure 4E,4F)。

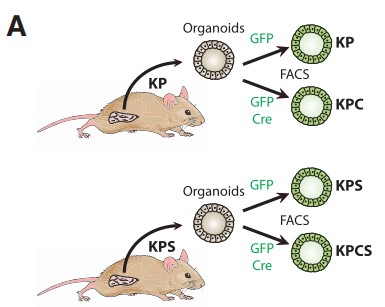
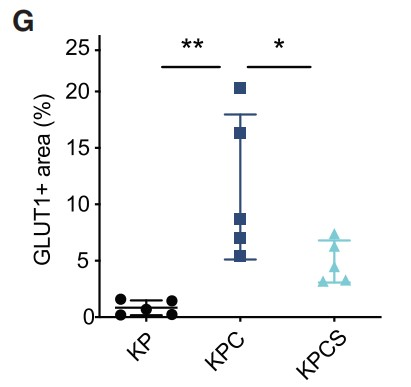
考虑到剪接受损导致HIF活性减弱,从而抑制PDAC进展的可能性。作者从KP和KPS小鼠中建立了三维(3D)类器官培养物(Figures 5A)。利用CRE重组酶的慢病毒转导诱导KRASG12D的表达、Trp53R172H的活化和Sf3b1的杂合子缺失,导致Sf3b1 mRNA和蛋白质水平降低(Figures 5B)。
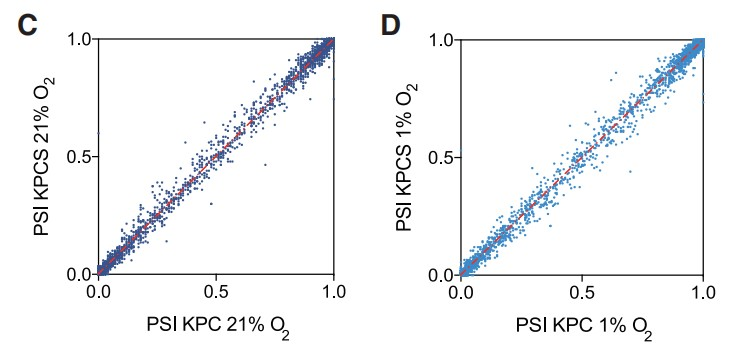
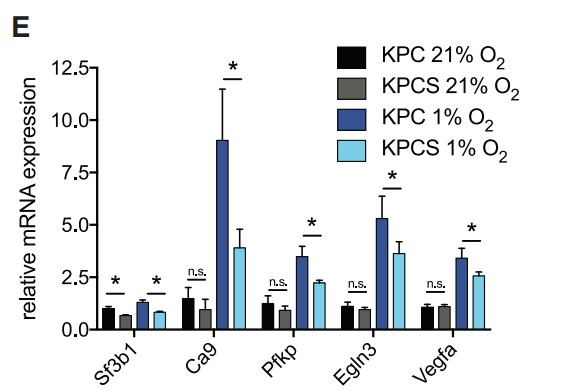
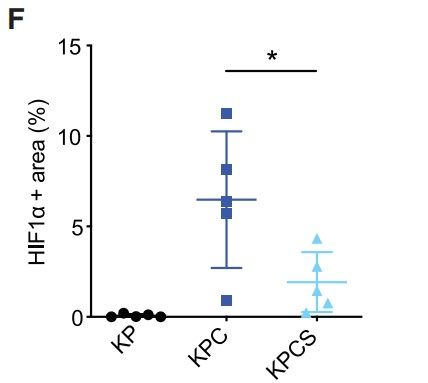
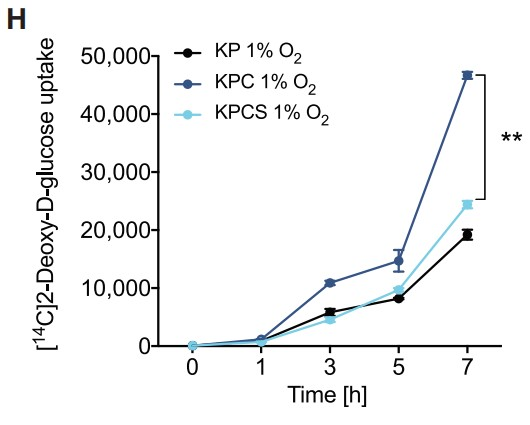
接下来,作者证实Hif1a和Hif1b的剪接在Sf3b1杂合缺失后没有发生显著改变,剪接的Hif1b外显子5的比例在两种基因型中相似。此外,作者还分析了常氧和低氧条件下KPC和KPCS类器官的全局剪接效率,但包括外显子跳跃、3’和 5’位点替代以及内含子保留等剪接 (PSI) 事件的百分比并未发现存在显著差异(Figures 5C, 5D)。此外,作者观察到缺氧状态下杂合子Sf3b1丢失时HIF靶基因表达减少,但在正常氧下则没有 (Figures 5E)。小鼠肿瘤的免疫组化实验证实了上述发现,与KPC小鼠相比,KPCS小鼠中HIF1α以及HIF靶标 GLUT1的表达降低(Figures 5F, 5G)。并且在糖酵解的功能测定中。用放射性标记的[14C]-2-脱氧-D-葡萄糖孵育类器官,在常氧条件下KPC和KPCS类器官间的葡萄糖摄取没有显著差异,但在缺氧条件下KPCS类器官的葡萄糖摄取减少 (Figure 5H)。与糖酵解功能测定的结果一致,KPCS类器官在缺氧条件下的生长速度明显慢于KPC类器官,但在常氧条件下则不然 (Figures 5I and 5J)。总之,上述结果表明,Sf3b1的杂合缺失通过降低癌细胞适应缺氧的能力来阻碍PDAC的形成和进展,突出了SF3B1-HIF1α在胰腺癌发病机制中的重要作用。

研究结论

作者证实SF3B1是缺氧诱导因子 (HIF)-1靶基因,可正向调节HIF1通路活性。通过与HIF1α发生物理性相互作用,SF3B1促进HIF1复合物与缺氧响应元件(HRE)结合以激活靶基因表达。为了进一步验证该机制与肿瘤进展的相关性,作者构建了胰腺癌小鼠模型,并通过对Sf3b1单等位基因缺失来降低SF3B1表达水平,最后作者发现SF3B1水平降低导致HIF信号传导受损,从而阻碍肿瘤的形成和进展。本研究揭示了SF3B1在HIF1信号传导中的重要作用,为SF3B1高表达与实体瘤侵袭性之间的联系提供了潜在的解释。

重点归纳

1. SF3B1水平决定对缺氧的转录适应。
2. SF3B1通过结合HIF1α而与HIF1复合物发生物理相互作用。
3. SF3B1-HIF1相互作用促进HIF1与缺氧响应元件结合。
4. Sf3b1的杂合性阻碍PDAC小鼠模型中胰腺癌的形成。
参考文献

Patrik Simmler, Ce´dric Cortijo, Lisa Maria Koch, et al. SF3B1 facilitates HIF1-signaling and promotes malignancy in pancreatic cancer[J]. Cell Reports, 2022











