20231201研究热点(ac4C/糖酵解/肿瘤免疫)大集合,组学技术(acRIP-seq/ATAC-seq/ChIP-seq)再建功!

#
引言
宫颈癌(CCa)的发病率和死亡率在全球排名第四。过去30年,常采用手术切除、放疗和化疗方案进行治疗,但复发或转移性(R/M)CCa患者的预后一直较差。最近对于CCa治疗主要通过针对免疫检查点进行阻断的免疫疗法(比如PD-1/PD-L1)。
RNA上目前发现存在着170多种不同类型的转录后修饰,包括m6A、m5C、m7G和ac4C修饰等。康测首家应用UMI数字标签去重纠错,搭配自动化IP工作站赋能提效,提供全面RNA修饰研究技术服务(m1A/m5C/m6A/m7G/ac4C)。N4-乙酰胞苷(ac4C)是重要的RNA修饰之一,能够影响mRNA的稳定性和翻译效率,并与多种疾病(炎症性疾病、代谢性疾病、自身免疫性疾病、癌症)的发展相关。
NAT10是ac4C writer,催化rRNA、tRNA和mRNA上ac4C修饰。NAT10与肝癌、膀胱癌和急性髓系白血病的发病有关,但在CCa发生和发展中的作用仍有待研究。
肿瘤细胞依靠糖酵解产生能量,而能量代谢改变或失调是肿瘤的基本特征。乳酸生成增加与肿瘤的复发、转移显著相关。目前,关于CCa发生和发展中ac4C修饰参与调解糖酵解代谢的报道较少。
本研究中,作者利用ChIP-seq、ATAC-seq、CUT&Tag、RNA-seq和Ribo-seq等多种组学技术探究了NAT10介导的ac4C修饰在CCa糖酵解代谢和免疫重编程中的作用机制。
#
研究结果
一、CCa中NAT10的上调表达促进肿瘤进展(关联表型与基因)
借助免疫组织化学(IHC),作者发现CCa样本中NAT10蛋白表达上调(Figure 1a)。并且,CCa中NAT10的上调表达与高肿瘤分期(Figure 1b)、淋巴结转移(Figure 1c)以及Ki-67的上调表达(Figure 1d)相关(ps:Ki-67作为肿瘤细胞增殖和预后不良的标志物)。
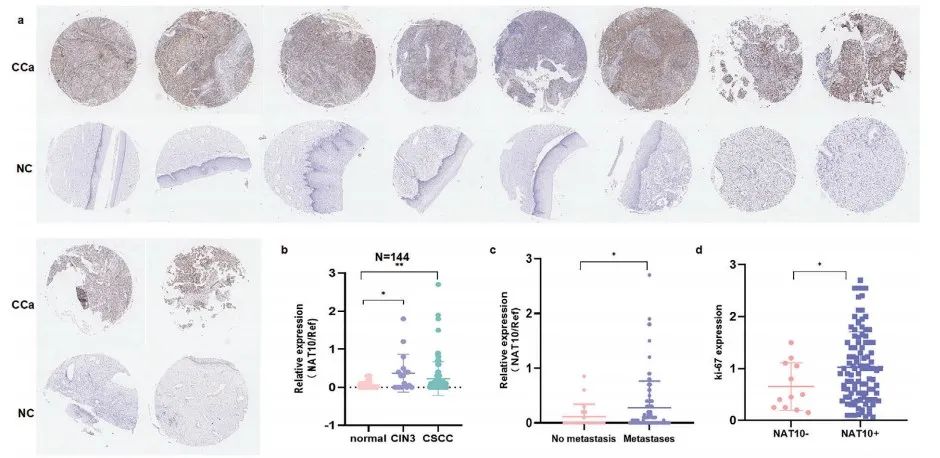
利用SangerBox对TCGA数据库进行分析,作者证实CCa中NAT10的表达上调。并且,NAT10的表达与肿瘤免疫密切相关(Figure 1e-h)。Kaplan‒Meier分析揭示CCa中NAT10的高表达与患者较短的总生存期(OS)和无病生存期(DFS)有关 (Figure 1i,j)。
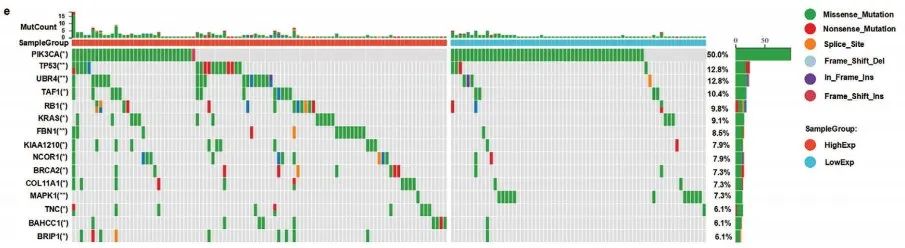
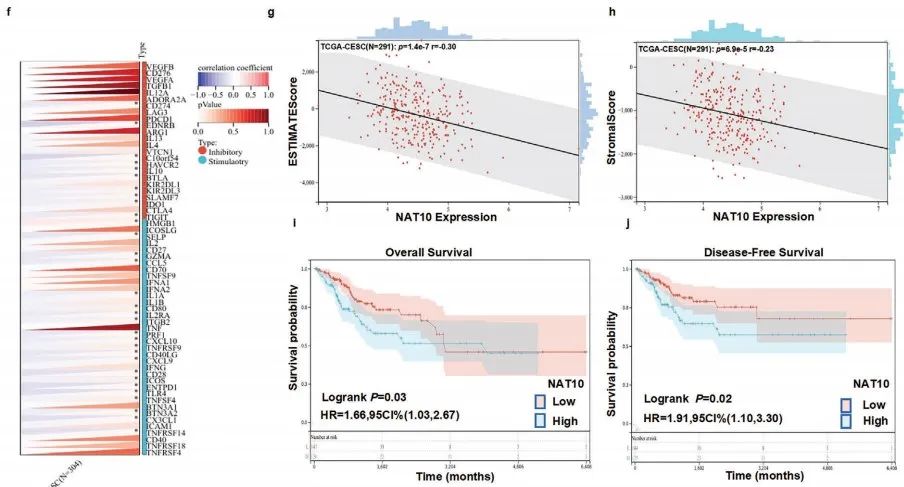
综上所述,CCa中NAT10的上调表达促进肿瘤进展。
二、CCa中HOXC8结合NAT10启动子并促进转录(阐明NAT10表达的上游调控机制)
ATAC-seq是研究染色质构象的主流工具,RNA-seq是研究基因表达的常用工具。ATAC-seq和RNA-seq的联合分析有利于明确调控元件的可及性与基因表达之间的联系。
作者联合ATAC-seq和RNA-seq数据筛选得到调节NAT10表达的唯一候选转录因子(TF)——HOXC8,并且MEME motif分析也揭示了HOXC8在NAT10启动子上的潜在结合位点 (Figure 2a-g)。
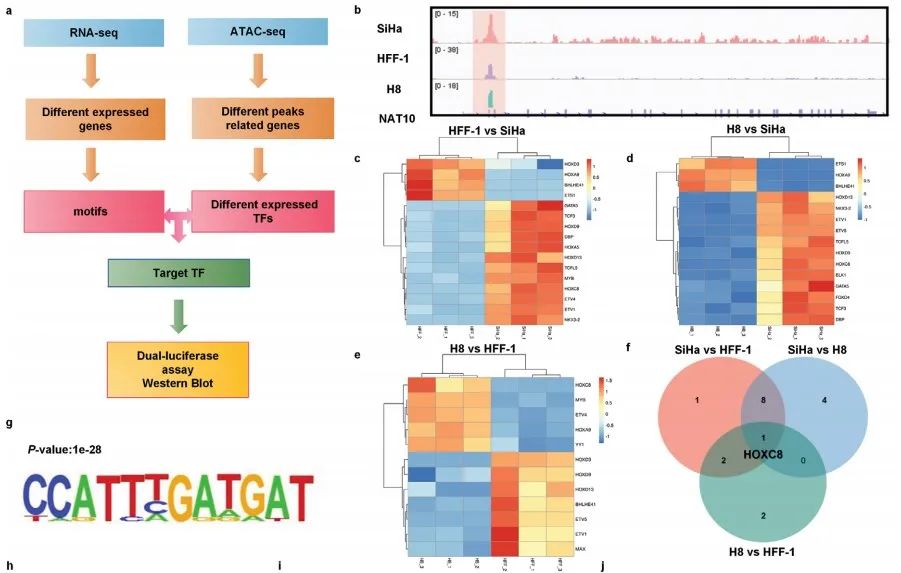
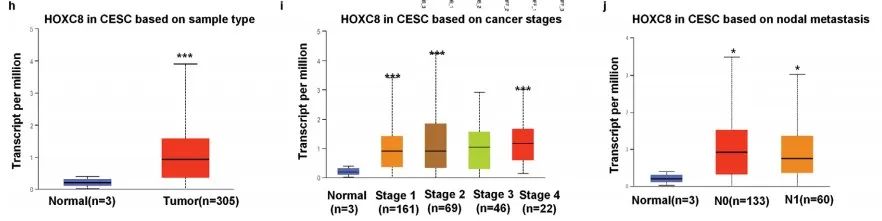
借助UALCAN对TCGA数据库进行分析,作者发现CCa中HOXC8 mRNA表达显著上调(Figure 2h),并与肿瘤分期和淋巴结转移呈正相关(Figure 2i,j)。此外,基因表达谱交互分析(GEPIA)表明:CCa中HOXC8与NAT10的表达呈正相关(Figure 2k),并且HOXC8 mRNA的高表达与较短的DFS有关(Figure 2l)。
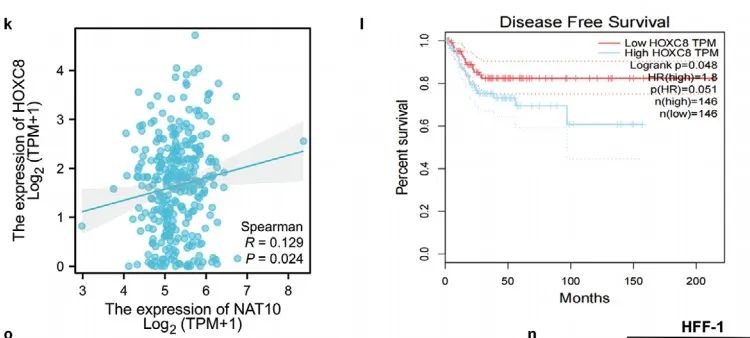
双荧光素酶实验证实HOXC8结合NAT10的启动子(Figure 2m)。RNA干扰实验证实HOXC8调控NAT10的表达(Figure 2n)。
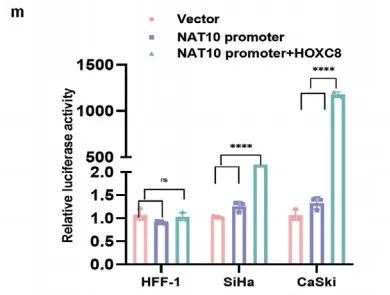

综上所述,CCa中HOXC8通过结合NAT10的启动子,促进转录来提高NAT10的表达 (Figure 2o)。
三、敲低NAT10抑制体外和体内CCa细胞增殖、侵袭和转移(阐明NAT10在CCa中的功能)
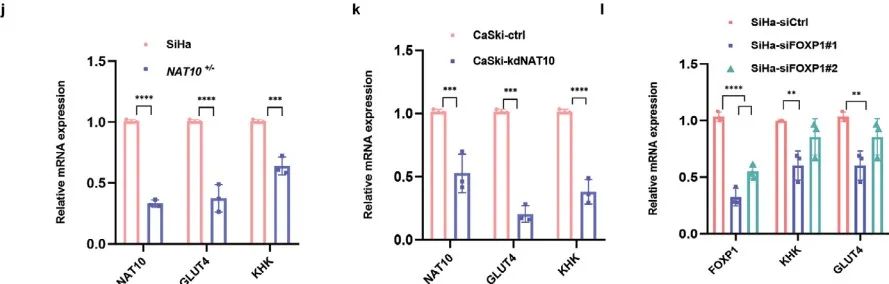
作者借助CRISPR/Cas9基因编辑技术在SiHa细胞中构建了NAT10杂合敲低细胞系(NAT10+/-),并利用sgRNA分别在CaSki和U14细胞中敲低NAT10(kdNAT10)(Figure 3c)。随后,作者利用各类细胞进行体外和体内的功能检测。
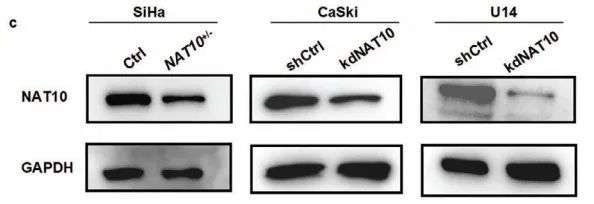
体外检测(Figure 3d-f):
1)CCK8测定表明敲低NAT10显著抑制细胞增殖。
2)克隆形成实验表明敲低NAT10明显抑制克隆形成。
3)Transwell测定表明敲低NAT10有效抑制细胞迁移和侵袭。
体内检测(Figure 3g-j):
1)生长曲线揭示敲低NAT10显著抑制小鼠体内肿瘤的生长。
2)形态大小观察揭示敲低NAT10导致肿瘤的生长速率降低、肿瘤体积减小。
3)活体动物成像和荧光素酶标记揭示敲低NAT10显著抑制小鼠体内肿瘤的生长。
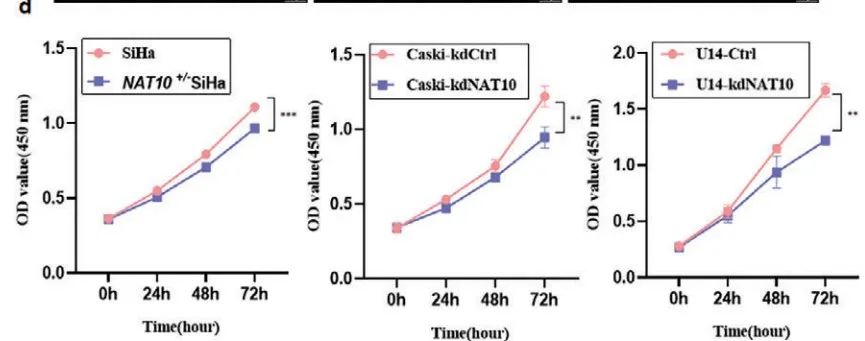
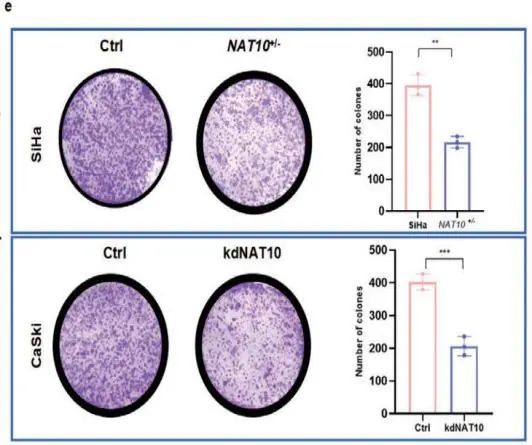
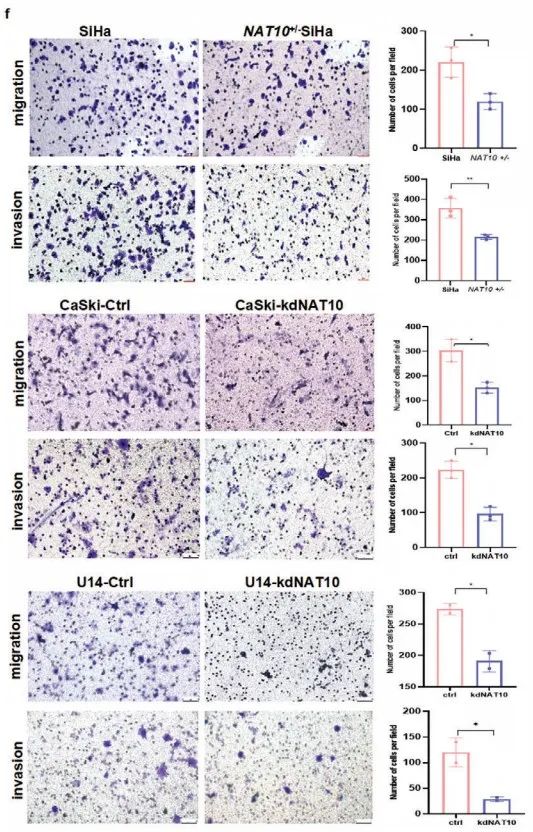
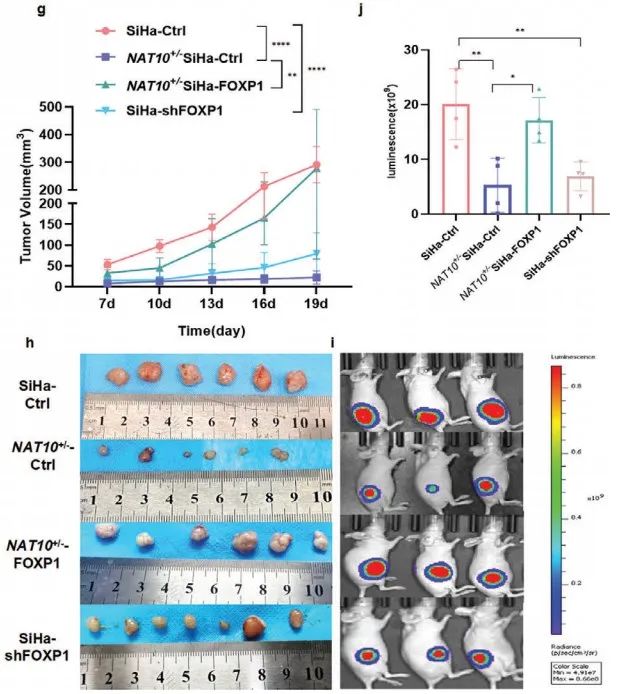
综上所述,NAT10促进CCa细胞增殖、侵袭和转移。
四、NAT10介导FOXP1上ac4C修饰,调控翻译效率(筛选NAT10介导的ac4C修饰的下游靶基因)
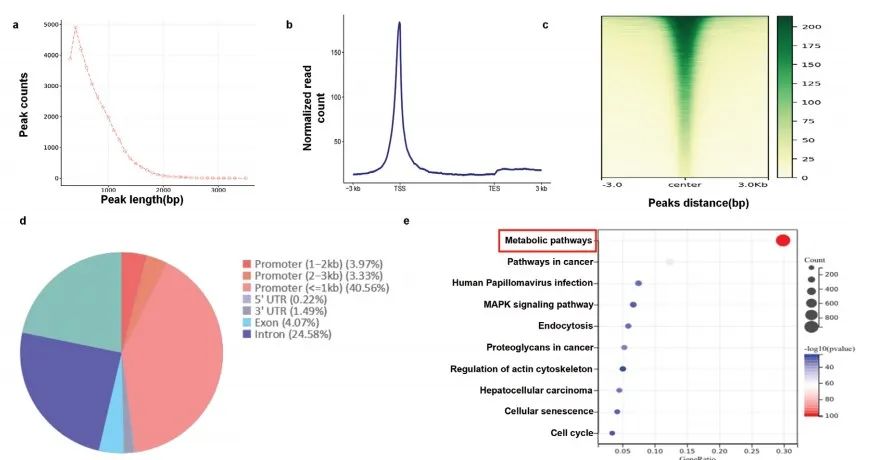
NAT10是唯一已知的ac4C“writer”,NAT10的表达水平影响ac4C修饰的形成。目前,acRIP-seq(抗体法)和ac4C-seq(化学法)是研究RNA上ac4C修饰的有利工具。此外,研究报道ac4C修饰影响mRNA的稳定性和翻译效率。通常来讲,通过检测放线菌素D处理后mRNA的半衰期来评估mRNA的稳定性,利用Ribo-seq检测翻译效率。本研究中,作者对野生型和NAT10+/- SiHa细胞进行acRIP-seq、RNA-seq和Ribo-seq,筛选CCa中NAT10介导的ac4C修饰的靶基因(Figure 4a)。
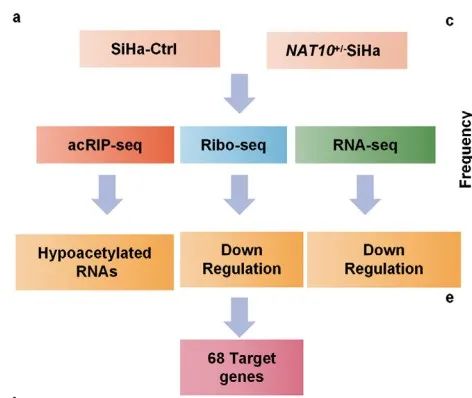
通过acRIP-seq,作者鉴定到808个ac4C peak和特征性“CXXCXXCXX”motif(Figure 4b)。相较SiHa-Ctrl细胞,NAT10+/- SiHa细胞中ac4C peak在CDS区占比降低 (Figure 4c)。并且,NAT10+/- SiHa细胞中mRNA的总体ac4C水平显著降低(Figure 4d,e)。此外。KEGG富集分析表明:差异基因在“细胞粘附”、“癌症通路”、“PI3K-Akt信号通路”、“mRNA监测通路”和“HPV感染通路”富集(Figure 4f)。上述数据说明:发生ac4C修饰的RNA可能参与调控CCa的发育。

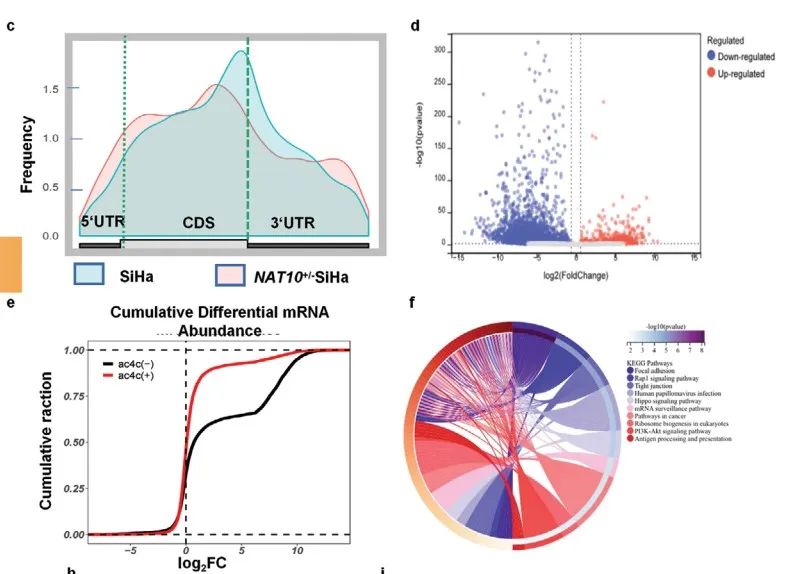
通过Ribo-seq,作者发现NAT10+/- SiHa细胞中转录本的翻译效率降低(Figure 4h)。
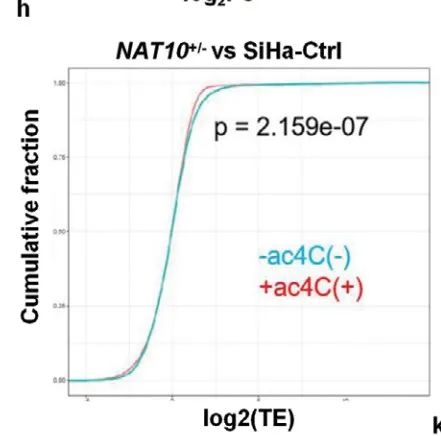
将acRIP-seq、Ribo-seq和RNA-seq结果进行overlap,作者共筛选出68个候选靶基因。其中,FOXP1 mRNA在敲低NAT10后变化最明显(Figure 4i)。并且,IGV显示FOXP1 mRNA上存在ac4C修饰,敲低NAT10后FOXP1 mRNA上ac4C修饰丰度降低(Figure 4j)

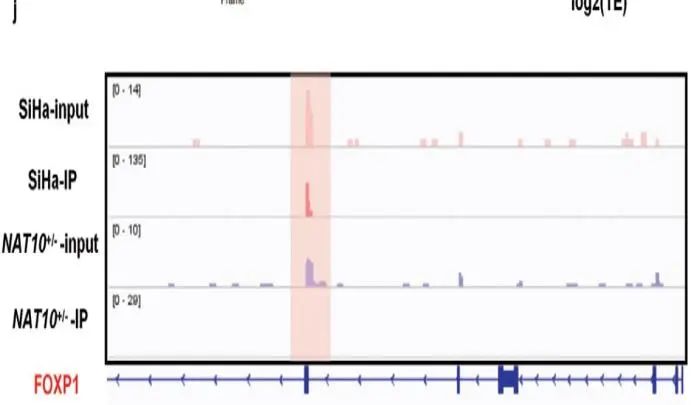
acRIP-qPCR证实SiHa细胞中FOXP1 mRNA上存在明显的ac4C修饰,并且敲低NAT10导致FOXP1 mRNA上ac4C修饰水平显著降低(Figure 4k)。WB揭示转染野生型NAT10(NAT10-wt,Flag标记)而非N-乙酰转移酶修饰位点突变的NAT10(NAT10-mut,Flag标记)导致FOXP1蛋白表达上调 (Figure 4l,m)。综上所述,CCa中NAT10介导FOXP1 mRNA上ac4C修饰。
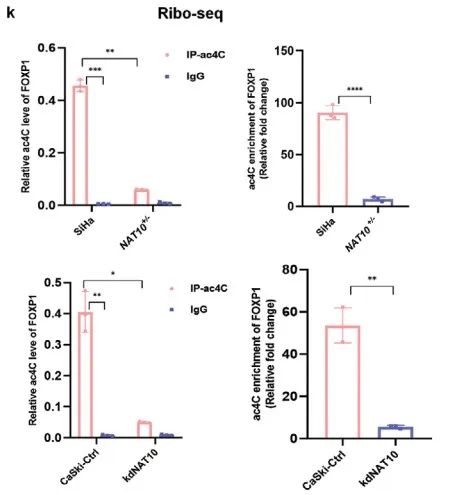
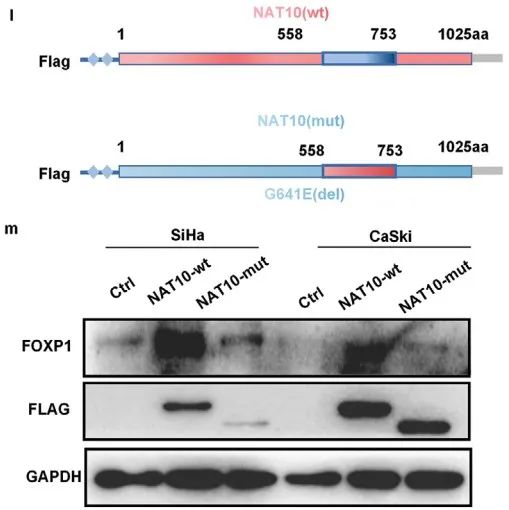
虽然敲低NAT10会导致FOXP1蛋白水平显著降低,但不会导致FOXP1 mRNA水平发生显著变化(Figure 4n,o)。mRNA稳定性检测表明敲低NAT10不会显著影响FOXP1 mRNA的稳定性(Figure 4p)。
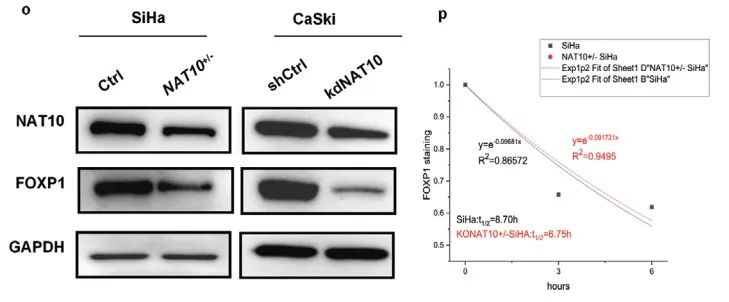
结合Ribo-seq结果,作者推测NAT10介导FOXP1 mRNA上ac4C修饰,调控其翻译效率。
五、过表达FOXP1可以改善由NAT10耗竭导致的肿瘤抑制(阐明FOXP1在CCa中的功能)
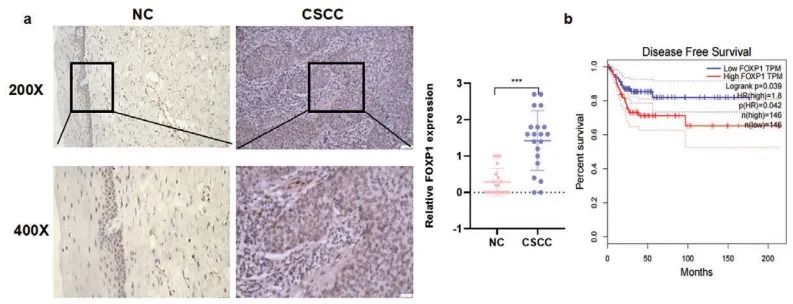
IHC揭示CCa组织中FOXP1蛋白水平显著提高(Figure 5a)。Kaplan-Meier分析表明CCa患者中表达上调的FOXP1 mRNA与较差的DFS预后相关(Figure 5b)。并且,CCa中FOXP1与NAT10的表达呈正相关(Figure 5c)。

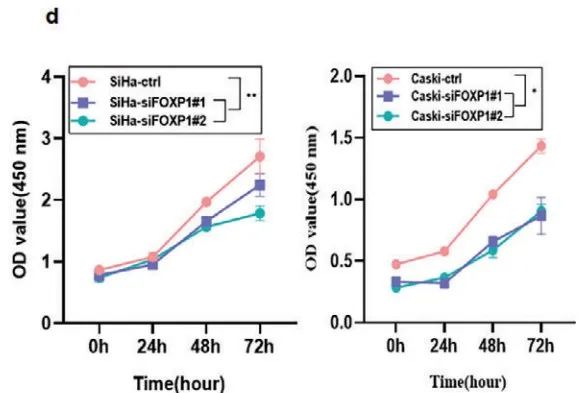
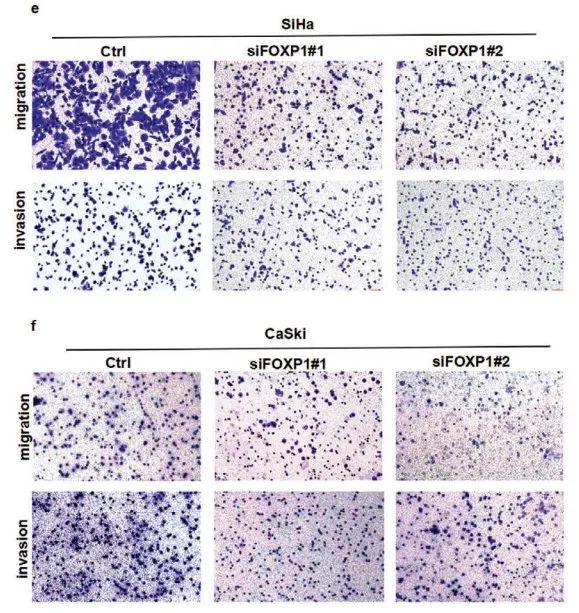
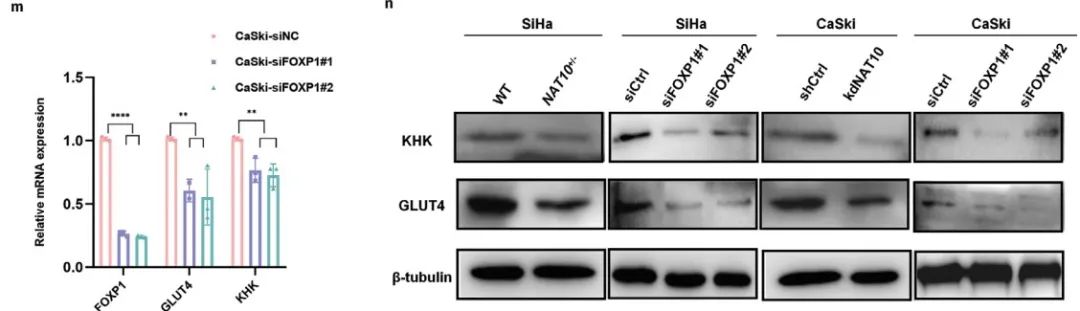
作者利用两个不同的siRNA分别在SiHa和CaSki细胞中敲低FOXP1(siFOXP1#1、siFOXP1#2)。随后功能检测表明:敲低FOXP1显著抑制CCa细胞增殖(Figure 5d)、迁移和侵袭(Figure 5e-g)。

作者在NAT10敲低的SiHa和CaSki细胞中过表达FOXP1(Figure 5h)。Transwell实验表明过表达FOXP1有效地恢复了由敲低NAT10导致的CCa细胞迁移和侵袭能力的降低(Figure 5i-k)。
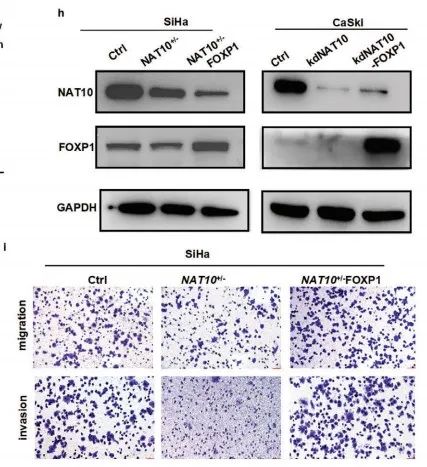
综上所述,过表达FOXP1可以改善CCa中由NAT10耗竭导致的肿瘤抑制。
六、FOXP1结合GLUT4和KHK启动子,激活转录来促进糖酵解(筛选FOXP1调控的下游靶基因)
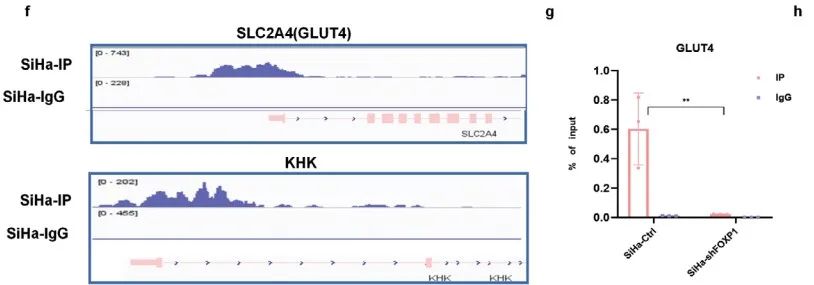
考虑到FOXP1的细胞核定位以及作为转录调节因子的功能,作者利用CUT&Tag筛选FOXP1结合的下游靶基因,并将重心放在糖酵解的关键酶上(Figure 6a-e)。
IGV揭示FOXP1在GLUT4和KHK启动子区显著富集(Figure 6f)。随后,ChIP‒qPCR证实SiHa细胞中FOXP1在GUMT4启动子区明显富集。敲低FOXP1后,FOXP1在GUMT4启动子区的富集明显降低(Figure 6g)。
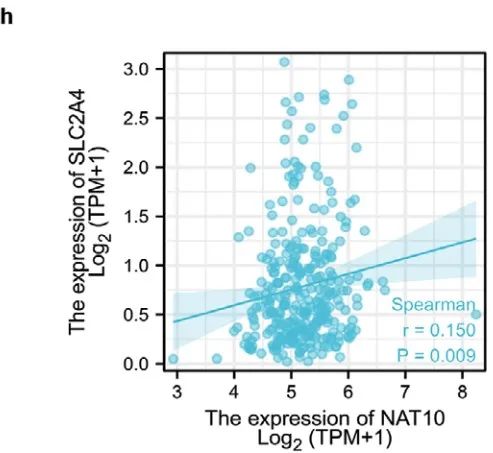
利用GEPIA对TCGA数据库进行分析,作者发现:GLUT4(SLC2A4)、KHK均与NAT10的表达呈正相关(Figure 6h,i)。此外,qRT‒PCR(Figure 6j–m)和WB (Figure 6n)证实敲低NAT10或FOXP1导致GLUT4和KHK mRNA和蛋白表达受到抑制。

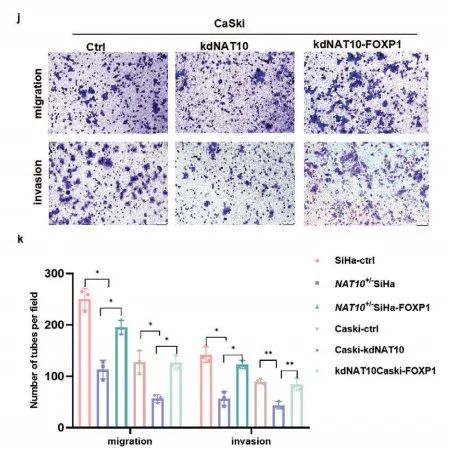
最后,作者还检测了糖酵解相关指标,如细胞外酸化率(ECAR)、葡萄糖消耗、乳酸产生和ATP水平。结果表明:敲低NAT10或FOXP1导致细胞葡萄糖消耗减少、乳酸和ATP产生减少(Figure 7a-d),而在NAT10敲低细胞中过表达FOXP1可以挽救上述表型(Figure 7e-h)。ECAR测定进一步证实敲低NAT10或FOXP1降低CCa中糖酵解(Figure 7i-l),而在NAT10敲低细胞中过表达FOXP1可以一定程度恢复CCa中糖酵解(Figure 7m,n)。但是,NAT10-mut转染的CCa细胞中糖酵解一直维持在较低水平(Figure 7o,p)。

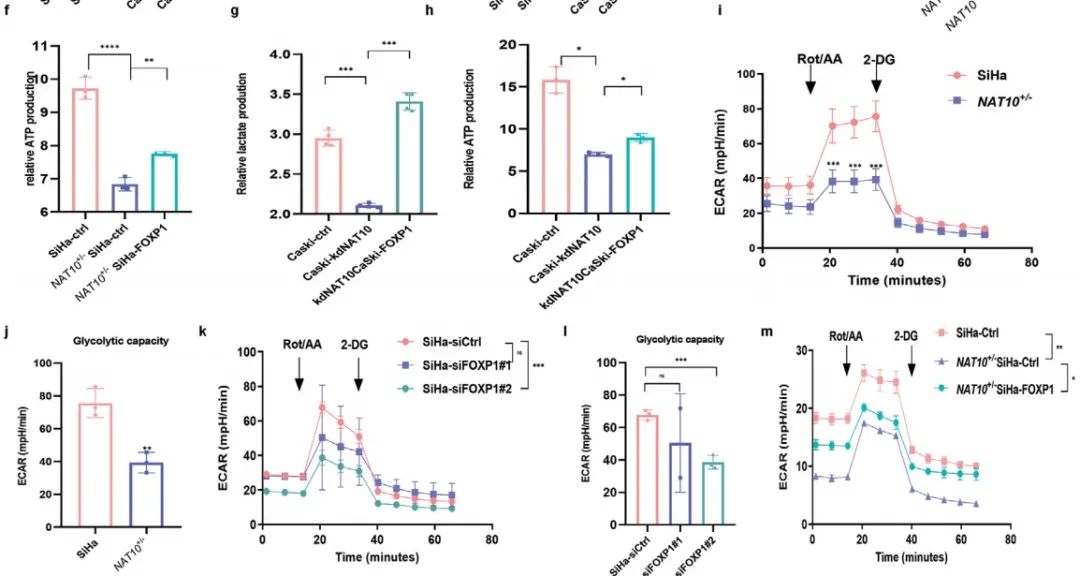

综上所述,CCa中FOXP1结合GLUT4和KHK启动子,激活转录来促进糖酵解。
七、NAT10/ac4C/FOXP1轴增加高度糖酵解下肿瘤中的Treg浸润(挖掘临床价值)
CCa中NAT10和FOXP1表达上调促进了肿瘤细胞增殖、侵袭、迁移和糖酵解能力,作者推测NAT10介导的FOXP1 mRNA上ac4C修饰可能对免疫逃避也至关重要(Figure 8a)。
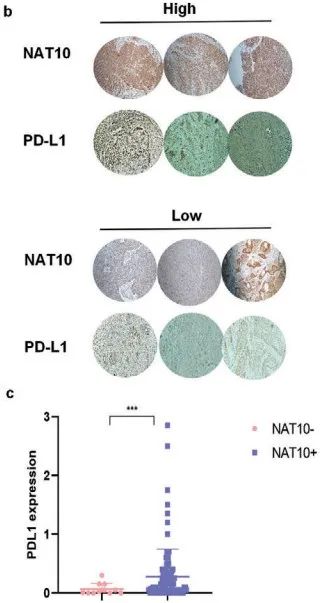
IHC揭示CCa中NAT10和PD-L1的表达呈正相关(Figure 8b,c),WB则进一步证实了CCa中NAT10、FOXP1和PD-L1之间的正相关关系(Figure 8d)。
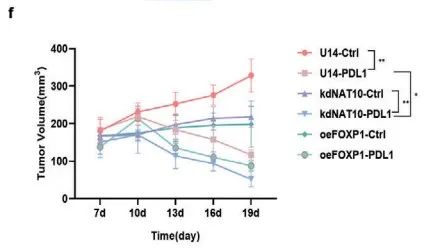
随后,作者分别构建了皮下注射野生型U14(U14-Ctrl)、敲低NAT10 U14(U14-kdNAT10)和过表达FOXP1 U14(U14-oeFOXP1)细胞的小鼠模型。各小鼠模型分别用抗IgG或PD-L1的抗体处理后再进行相关检测(Figure 8e)。
与IgG抗体处理相比,PD-L1抗体处理的小鼠模型中肿瘤体积减小、生长减缓。并且敲低NAT10和PD-L1抗体处理的联合治疗方案对肿瘤生长的抑制最显著 (Figure 8f,g)。

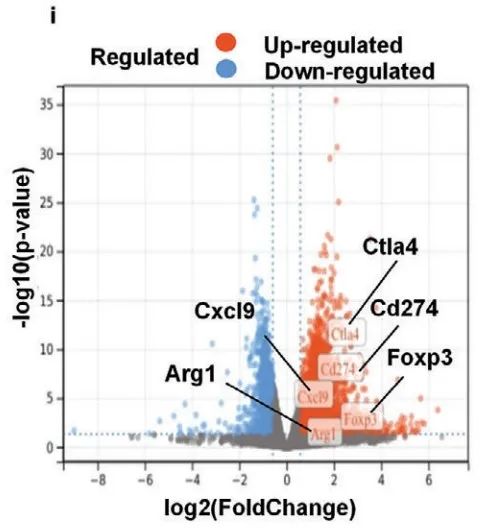
接着,作者对皮下注射U14-Ctrl和U14-oeFOXP1的小鼠模型进行了RNA-seq。火山图显示CD274、CTLA4、CXCL9、ARG1和FOXP3在U14-oeFOXP1中表达上调(Figure 8i),这意味着FOXP1可能调节一些检查点基因的表达。
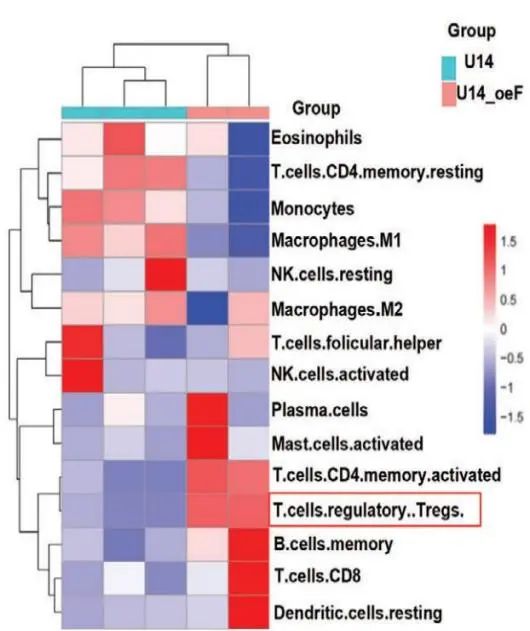
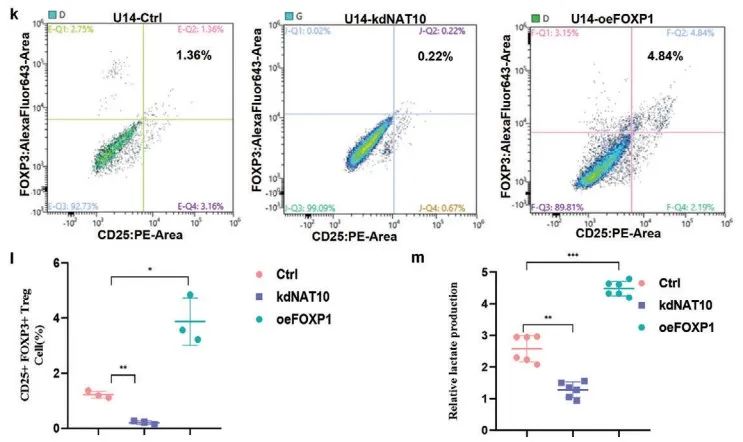
最后,作者使用CIBERSORT算法对野生型和过表达FOXP1 U14中肿瘤浸润免疫细胞(TIIC)进行相关性分析。其中,FOXP1的过表达与调节性T细胞(Tregs)、激活的CD4+ T细胞的浸润呈正相关,但与M1巨噬细胞、静息NK细胞和静息CD4+ 记忆T细胞的浸润呈负相关(Figure 8j)。流式细胞术表明,FOXP1表达上调促进肿瘤微环境(TME)中Treg浸润,而敲低NAT10显示出相反趋势 (Figure 8k,l)。此外,与U14-Ctrl相比,U14-oeFOXP1中乳酸产生增多,而U14-kdNAT10中乳酸产生减少(Figure 8m)。
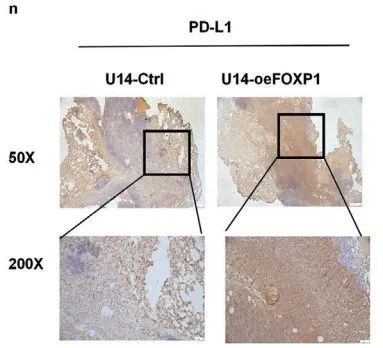
研究报道:暴露于乳酸水平高的TME中,Tregs的PD-1表达会显著上调。而IHC也证实U14-oeFOXP1组TME中PD-L1表达上调(Figure 8n)。综上所述,CCa中靶向NAT10-FOXP1轴的治疗不仅可以抑制肿瘤细胞糖酵解,还可以减少Treg群体浸润到TME中、抑制PD-L1上调表达,最终抑制肿瘤进展。
#
研究总结
1)利用IHC和对TCGA数据库分析,作者发现CCa中NAT10的表达上调并促进肿瘤进展。
2)通过ATAC-seq和RNA-seq联合分析,鉴定出HOXC8结合NAT10启动子,并调控NAT10表达。随后,作者借助双荧光素酶和RNA干扰实验进行了验证。
3)体外和体内功能检测:敲低NAT10抑制体外和体内CCa细胞增殖、侵袭和转移。
4)三组学acRIP-seq、RNA-seq和Ribo-seq联合分析,鉴定出FOXP1是NAT10介导的ac4C修饰的下游靶基因。随后,作者借助acRIP-qPCR和WB进行了验证。再结合mRNA稳定性检测和Ribo-seq结果,作者推测NAT10介导FOXP1 mRNA上ac4C修饰,调控其翻译效率。
5)功能检测:敲低FOXP1显著抑制CCa细胞增殖、迁移和侵袭。但在NAT10敲低细胞中过表达FOXP1可以有效恢复CCa细胞迁移和侵袭能力。也就是说,过表达FOXP1可以改善CCa中由NAT10耗竭导致的肿瘤抑制。
6)通过CUT&Tag分析,鉴定出FOXP1结合GLUT4和KHK启动子,调控GLUT4和KHK表达。IGV和ChIP‒qPCR证实FOXP1结合GLUT4和KHK启动子,而qRT‒PCR和WB证实NAT10或FOXP1调控GLUT4和KHK表达。
7)糖酵解相关指标检测(ECAR、葡萄糖消耗、乳酸产生和ATP水平):敲低NAT10或FOXP1降低CCa中糖酵解,而在NAT10敲低细胞中过表达FOXP1可以一定程度恢复CCa中糖酵解。并且,FOXP1的表达与NAT10乙酰转移酶活性相关。
8)小鼠模型:CCa中靶向NAT10-FOXP1轴的治疗不仅可以抑制肿瘤细胞糖酵解,还可以减少Treg群体浸润到TME中、抑制PD-L1上调表达,最终抑制肿瘤进展。
#
参考文献
Xiaona Chen, Yi Hao, Yong Liu, et al. NAT10/ac4C/FOXP1 Promotes Malignant Progression and Facilitates Immunosuppression by Reprogramming Glycolytic Metabolism in Cervical Cancer[J]. Advanced Science, 2023
#
往期推荐











