快来看!中山大学附属第三医院最新这篇NC:m6A&铁死亡调控肝脏缺血/再灌注损伤的机制研究。
快来看!中山大学附属第三医院最新这篇NC:m6A&铁死亡调控肝脏缺血/再灌注损伤的机制研究
引言
老年肝脏更容易发生肝脏缺血/再灌注损伤(HIRI),这限制了其在肝移植中的应用。而HIRI潜在的分子机制尚未明确。
2024年6月,中山大学附属第三医院杨扬、郑俊、姚嘉和张英才老师共同通讯在Nature Communications(IF 16.6)上发表题为“FTO deficiency in older livers exacerbates ferroptosis during ischaemia/reperfusion injury by upregulating ACSL4 and TFRC”的研究文章,揭示了FTO介导的m6A修饰调节在缓解老年肝脏HIRI中的关键作用。研究表明,老年肝脏HIRI中,FTO表达下调。抑制了FTO结合Acsl4和Tfrc mRNA并降低其上m6A修饰水平的功能。导致Acsl4和Tfrc表达上调,最终加剧铁死亡。而NMN治疗可以增强FTO去甲基化酶活性,从而抑制铁死亡,并显著缓解老年肝脏HIRI。
康测科技为本研究提供UMI eCLIP-seq技术服务。文章中单碱基分辨率的eCLIP-seq精准定位FTO结合Acsl4和Tfrc mRNA的位点,与meRIP-seq、meRIP-qPCR相互印证,使得结果说服力Max。
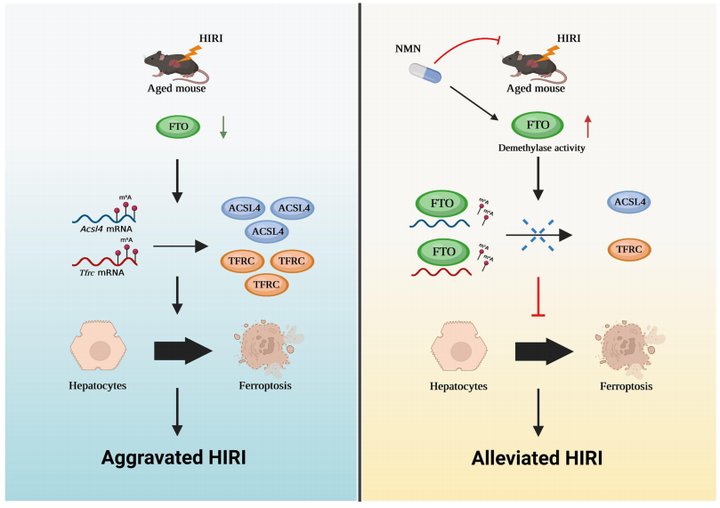
研究思路

研究结果
一、老年肝脏更容易发生IRI和铁死亡为了验证老年肝脏是否更容易发生IRI
作者首先进行人原位肝移植队列研究。与年轻组相比,老年组术后第1天血清AST和ALT水平升高(Fig. 1a)、术后第1天到第7天血清AST和ALT水平恢复放缓(Fig. 1b)、肝组织学变化明显以及肝细胞死亡增加(Fig. 1c-top, middle; Fig. 1d-left)。这些结果证实老年肝脏更容易发生IRI。

考虑到老年肝脏的生理变化和铁死亡特征,作者推测老年肝脏更容易发生铁死亡。随后,这一假设得到证实:老年肝脏中ROS积累(Fig. 1c-bottom;Fig. 1d-right)、脂质过氧化增强(Fig. 1e)、铁死亡相关蛋白的表达明显改变 (Fig. 1f)。
此外,HIRI小鼠模型(Fig. 1g-m)证明:老年肝脏更容易受到IRI影响,铁死亡程度更高。

二、抑制铁死亡显著缓解老年肝脏HIRI
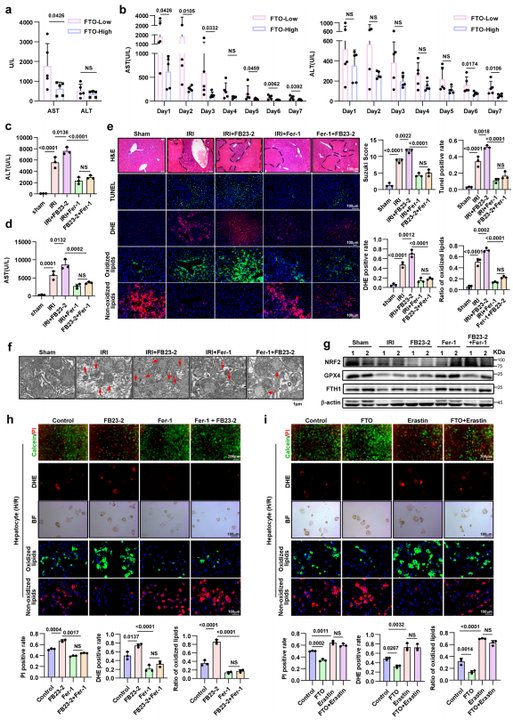
接下来,作者探索了铁死亡在老年肝脏HIRI中的作用。Fer-1(铁死亡抑制剂)处理显著减轻老年肝脏HIRI、降低ROS积累和脂质过氧化(Fig. 2a-c)、改善H/R导致的肝细胞损伤(Fig. 2d-g)。这进一步强调了铁死亡在老年肝脏HIRI中的关键作用。

三、FTO可能通过调节m6A甲基化参与调控老年肝脏HIRI
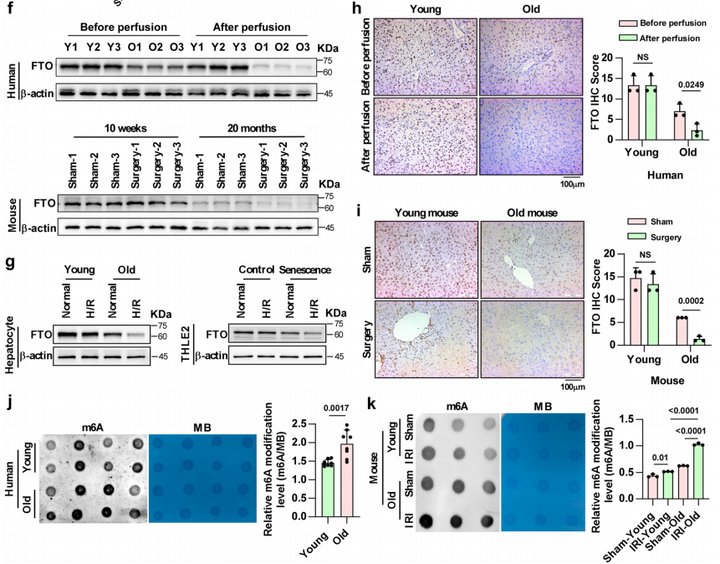
为了鉴定影响老年肝脏HIRI的因子,作者首先利用LC-MS筛选差异表达蛋白(Fig. 3a, c)。并基于以下标准进一步筛选参与老年肝脏HIRI调控的关键分子:(1)差异表达蛋白可能与老年肝脏对IRI的易感性增加有关;(2)IR期间表达改变的蛋白也可能参与该过程;(3)关注IR期间仅在老年肝脏中表达变化的蛋白。FTO、NAT8和ABLIM1被筛选出(Fig. 3e),再结合已知分子功能,作者最终选择FTO和NAT8作后续研究。

接着,作者利用WB(Fig. 3f, g)和IHC(Fig. 3h, i)检测FTO和NAT8的表达。结果表明,FTO随老年或IR表达下调,但NAT8变化不显著。FTO是m6A去甲基化酶,可以通过降低m6A甲基化水平发挥作用。Dot blot显示,HIRI期间m6A甲基化水平上调,并且老年高于年轻(Fig. 3j, k)。综上所述,作者推测表达下调的FTO可能通过调节m6A甲基化参与调控老年肝脏HIRI。
四、FTO通过抑制铁死亡来缓解老年肝脏HIRI
通过临床队列(Fig. 4a, b)、HIRI小鼠模型(Fig. 4c-g)和体外实验(Fig. 4h, i),作者进一步阐明FTO对老年肝脏HIRI的影响。结果证明,FTO主要通过抑制铁死亡来缓解老年肝脏HIRI,此过程与FTO去甲基化酶活性相关。
五、FTO通过m6A去甲基化抑制ACSL4和TFRC mRNA的稳定性
紧接着,作者探索了FTO调节铁死亡的潜在机制。针对m6A甲基化,作者首选meRIP-seq。富集分析显示,下调的m6A peaks在铁死亡通路有富集(Fig. 5d)。IGV显示,过表达FTO降低Acsl4 5'UTR和Tfrc 3'UTR区m6A水平(Fig. 5e)。Acsl4和Tfrc报道可以调控铁死亡。 MeRIP-qPCR证实过表达FTO降低Acsl4和Tfrc上m6A水平(Fig. 5f)。此外,作者还利用单碱基分辨率的eCLIP-seq作进一步验证(Fig. 5g),使得“FTO结合Acsl4和Tfrc,并降低两者m6A水平”的结论更具说服力。

通过RT-qPCR、WB和IHC,作者证实FTO介导的m6A修饰负调控ACSL4和TFRC的表达(Fig. 5h-j)。

基于m6A调节mRNA的稳定性和降解,作者进行了mRNA半衰期测定。过表达FTO导致Acsl4和Tfrc mRNA半衰期缩短(Fig. 5k, l)。结合WB和RIP验证,作者发现YTHDC2是Acsl4的m6A reader,而YTHDF2是Tfrc的m6A reader(Fig. 5m-p)。综上所述,FTO通过降低Acsl4和Tfrc mRNA上m6A水平,缩短mRNA半衰期,从而下调Acsl4和Tfrc表达。

六、FTO依赖ACSL4和TFRC调控铁死亡,缓解老年肝脏HIRI
为了强调ACSL4和TFRC在FTO介导的缓解老年肝脏HIRI中的作用,作者利用AAV8敲低ACSL4或TFRC。联合FB23-2(FTO抑制剂)处理的体内实验证明FTO通过调节ACSL4和TFRC的表达影响铁死亡(Fig. 6a-d)。

敲低/过表达ACSL4或TFRC的体外实验也证实:FTO缓解老年肝脏HIRI依赖于对ACSL4和TFRC表达的调节(Fig. 6e-n)。

七、NMN通过增强FTO去甲基化酶活性来缓解老年肝脏HIRI
NMN是NAD+前体之一,补充NMN可以增加NAD+含量。而NADP+和NAD+被报道能够增强FTO去甲基化酶活性。那么,NMN是否能作为缓解老年肝脏HIRI的治疗策略?
作者发现NMN治疗可以增强FTO去甲基化酶活性(Fig. 7d)、抑制铁死亡(Fig. 7e-h),并显著缓解老年肝脏HIRI(Fig.7a-c)。

参考文献
Rong Li, Xijing Yan, Cuicui Xiao, et al. FTO deficiency in older livers exacerbates ferroptosis during ischaemia/reperfusion injury by upregulating ACSL4 and TFRC[J]. Nature Communications, 2024













