IF 24.3|院士团队最新成果解读:ESCC耐药怎样拓展研究?
IF 24.3|院士团队最新成果解读:ESCC耐药怎样拓展研究?
食管鳞状细胞癌(ESCC)是世界范围内常见、死亡率极高的食道癌类型。目前,主要使用铂类化疗药物对ESCC患者进行治疗。但由于化疗耐药,导致治疗失效和肿瘤转移时常发生。ESCC顺铂耐药的分子机制尚未明确。
2024年5月,中国医学科学院肿瘤医院赫捷院士团队在Drug Resistance Updates(IF 24.3)发表题为“KLF12 Interacts with TRIM27 to affect Cisplatin Resistance and Cancer Metastasis in Esophageal Squamous Cell Carcinoma by regulating L1CAM Expression”的研究文章,揭示了TRIM27/KLF12-L1CAM调控ESCC顺铂耐药和肿瘤转移的分子机制,为ESCC治疗提供新的潜在靶点。
整篇文章干湿结合、验证扎实,值得疾病耐药研究的同学们借鉴学习,特别是KLF12结合伴侣的鉴定以及基于TRIM27功能延伸到泛素化的研究拓展,让人眼前一亮。康测科技为本研究提供ChIP-seq测序分析服务。
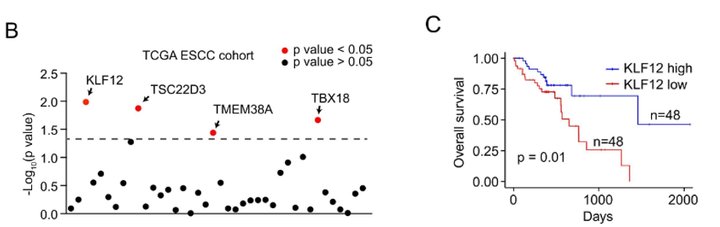
为了探究ESCC化疗耐药的机制,作者首先构建了PDX模型(Fig. 1A),并对其中化疗耐药和化疗敏感模型进行了RNA-seq分析。结合TCGA数据库,作者发现KLF12在化疗敏感模型中高表达,并与ESCC患者良好的生存预后相关(Fig. 1B和1C)。
为了探究KLF12表达与ESCC顺铂耐药的关联,作者在KYSE30和KYSE70细胞中敲低KLF12,但在KYSE150细胞中过表达KLF12。体外/内实验表明敲低KLF12显著增强ESCC顺铂耐药(Fig. 1G-1K),而过表达KLF12则增强ESCC对顺铂的敏感性。
为了探究KLF12影响ESCC顺铂耐药的分子机制,作者分别对KLF12敲低和对照细胞、KLF12过表达和对照细胞进行了RNA-seq。结合韦恩图筛选 (Fig. 2C)、qRT-PCR和WB验证(Fig. 2D和2E),作者发现KLF12显著抑制L1CAM表达。
考虑到KLF12可能作为转录因子,调控L1CAM的转录。作者首先对已发表的、来自HEK293和HepG2细胞的KLF12 ChIP-seq数据进行分析,并在L1CAM上发现两处KLF12结合位点(Fig. 2F)。随后,作者利用ChIP-qPCR (Fig. 2G)在HEK293和KYSE30细胞中加以证实。
为了鉴定KLF12在L1CAM上具体的结合位点,作者首先利用de novo motif分析,在L1CAM 5’UTR上游鉴定到(GCCC)n和(GGGC)n motif(promoter1),在exon 1上游鉴定到GGGC-rich motif(promoter2)(Fig. 2H和2I)。接着,通过突变&荧光素酶实验(Fig. 2I-2K)、EMSA验证,作者证明KLF12可以通过结合L1CAM promoter1/2来抑制L1CAM转录。
3、KLF12通过调节L1CAM的表达来影响ESCC顺铂耐药和肿瘤转移
为了进一步验证KLF12-L1CAM-ESCC顺铂耐药的关联,作者在KYSE30细胞中过表达L1CAM。体外/内实验表明过表达L1CAM增强ESCC顺铂耐药。此外,沉默L1CAM可以消除由KLF12耗竭产生的ESCC顺铂耐药。而过表达L1CAM也能抑制由KLF12过表达产生的ESCC顺铂敏感 (Fig. 3A)。此外,Transwell实验显示敲低KLF12显著增强ESCC细胞迁移能力,并可通过下调L1CAM消除。
临床队列研究也表明,ESCC中KLF12与L1CAM存在负调控关系,并与顺铂耐药显著关联(Fig. 3E-3G)。
为了进一步拓展研究,作者在KYSE30和HEK293细胞中表达Flag-KLF12,并利用Flag IP-MS鉴定与KLF12互作的蛋白。结合韦恩图筛选 (Fig. 4B),Co-IP (Fig. 4C和4D)、共定位分析 (Fig. 4E)和GST pulldown验证(Fig. 4F),作者发现TRIM27与KLF12互作 。
为了明确TRIM27与KLF12的互作域,作者构建了不同的TRIM27和KLF12截断,借助Co-IP和WB验证,作者发现KLF12 N端区域缺失(KLF12 Δ1-100截断)或TRIM27 RING/B box域缺失都会干扰KLF12和TRIM27之间的相互作用(Fig. 4G和4H)。
5、TRIM27解除KLF12对L1CAM的转录抑制
为了弄清TRIM27对KLF12的影响,作者在KYSE30和KYSE70细胞中敲低TRIM27。qRT-PCR表明敲低TRIM27抑制L1CAM表达,但不影响KLF12。随后,作者整合TRIM27敲低和对照细胞、KLF12敲低和对照细胞的RNA-seq,利用韦恩图筛选(Fig. 5C)和qRT-PCR验证(Fig. 5D),揭示TRIM27和KLF12共调控L1CAM表达。此外,Flag-KLF12 ChIP-seq证实过表达TRIM27降低KLF12在L1CAM启动子区的结合丰度(Fig. 5F)。WB也显示敲低TRIM27会抑制L1CAM表达,但对KLF12蛋白稳态无显著影响(Fig. 5G)。ChIP-qPCR(Fig. 5H)和荧光素酶实验(Fig.5I)表明TRIM27解除KLF12对L1CAM的转录抑制。
6、TRIM27介导KLF12 K326位点上泛素化
考虑到TRIM27是E3泛素蛋白连接酶,作者探索了TRIM27是否介导KLF12泛素化。利用label-free MS (Fig. 6A和6B) 、位点突变 (Fig. 6C),作者发现TRIM27介导KLF12的泛素化主要发生在 K326。
此外,作者还发现TRIM27介导的是K33-连接多泛素化(Fig. 6F和6G)。并且,KLF12的泛素化可能影响其对L1CAM的转录抑制(Fig. 6J)。
最后,作者探究了TRIM27在顺铂耐药和肿瘤转移中的潜在作用。体外/内实验表明TRIM27耗竭增强ESCC顺铂敏感并抑制肿瘤转移(Fig. 7A-7E)。临床队列研究证实TRIM27表达与ESCC患者的顺铂耐药显著关联。
Hao Zhang, Yujia Zheng, Zhen Wang, et al. KLF12 Interacts with TRIM27 to affect Cisplatin Resistance and Cancer Metastasis in Esophageal Squamous Cell Carcinoma by regulating L1CAM Expression[J]. Drug Resistance Updates, 2024